RESUMO
A eclâmpsia permanece como emergência obstétrica tempo‑dependente, com risco elevado de morte e sequelas quando há atrasos, omissões ou decisões precipitadas. Este artigo operacionaliza o mnemônico ABCDEFG [vias aéreas e oxigenação; ventilação; circulação e parcimônia hídrica; prevenção de dano neurológico com sulfato de magnésio (MgSO₄); reconhecimento e tratamento imediato da hipertensão grave e exames dirigidos; avaliação fetal; e decisão obstétrica] como protocolo integrado, alinhado à gramática do atendimento de urgência e às especificidades da gestante. A estrutura prioriza A–E, para só então avançar a F e G. São descritos critérios objetivos para manejo avançado da via aérea, metas operacionais da saturação periférica de oxigênio (SpO₂), conduta e meta terapêutica dos níveis pressóricos, preparo/monitorização do MgSO₄, painel laboratorial mínimo e indicações de neuroimagem. A decisão obstétrica da via de parto como preferencial é a vaginal, sendo a cesariana reservada a indicações específicas. O manuscrito propõe ainda elementos para implementação institucional: comunicação em alça fechada, simulação breve, auditoria de tempos críticos e indicadores (porta‑magnésio, porta‑controle pressórico e cesariana por traçado transitório). Ao traduzir evidências em rotinas exequíveis, o ABCDEFG busca reduzir variabilidade assistencial, encurtar tempos decisivos e favorecer escolhas obstétricas proporcionais ao risco.
Palavras-chave:
Eclâmpsia, Préeclâmpsia, Sulfato de magnésio, Emergências, Protocolos clínicos
ABSTRACT
Eclampsia remains a time-dependent obstetric emergency, with a high risk of death and sequelae when there are delays, omissions, or hasty decisions. This article operationalizes the ABCDEFG mnemonic [airway and oxygenation; ventilation; circulation and fluid management; prevention of neurological damage with magnesium sulfate (MgSO₄); immediate recognition and treatment of severe hypertension and targeted tests; fetal assessment; and obstetric decision] as an integrated protocol, aligned with the grammar of emergency care and the specificities of the pregnant woman. The structure prioritizes A-E, only then advancing to F and G. Objective criteria for advanced airway management, operational targets for peripheral oxygen saturation (SpO₂), conduct and therapeutic targets for blood pressure levels, preparation/monitoring of MgSO₄, minimum laboratory panel, and neuroimaging indications are described. The obstetric decision regarding the preferred route of delivery is vaginal, with cesarean section reserved for specific indications. The manuscript also proposes elements for institutional implementation: closed-loop communication, brief simulation, critical time auditing, and indicators (magnesium port, blood pressure control port, and cesarean section for transient tracing). By translating evidence into feasible routines, ABCDEFG seeks to reduce variability in care, shorten decision times, and favor obstetric choices proportional to risk.
Keywords:
Eclampsia, Preeclampsia, Magnesium sulfate, Emergencies, Clinical protocols
IntroduçãoA elevação da pressão arterial (PA) na gestação é um dos principais determinantes de morbimortalidade materna e perinatal. Entre as síndromes hipertensivas, a eclâmpsia – crises convulsivas tônico-clônicas generalizadas em paciente com pré‑eclâmpsia, na ausência de outra etiologia neurológica – é considerada pela Rede Brasileira de Estudos em Hipertensão na Gestação a complicação mais grave do espectro hipertensivo, exigindo resposta imediata e organizada.
1A carga global da doença apresenta contrastes marcantes: em países de alta renda, a incidência varia de 1,5 a 10 casos por 100.000 nascimentos, enquanto em países de baixa e média renda pode atingir 19,6 a 142 por 100.000.
2 Nessas regiões, o risco de evolução para eclâmpsia e de morte materna é até dez vezes maior, refletindo desigualdades de acesso, prontidão e qualidade da assistência.
3,4As complicações incluem hemorragia intracerebral, edema agudo de pulmão, síndrome HELLP, lesão renal aguda, cegueira cortical e parada cardiorrespiratória, podendo acometer até 70% dos casos não tratados ou tratados tardiamente.
5,6 A mortalidade materna varia de zero a 14%, mas diminui substancialmente com protocolos estruturados.
No binômio materno-fetal, a convulsão compromete imediatamente a oxigenação e perfusão uteroplacentária, com risco de sofrimento fetal agudo. Alterações típicas da frequência cardíaca fetal (FCF) após a convulsão são geralmente transitórias e se resolvem com a estabilização materna. Assim, estabilizar a mãe é a forma mais eficaz de proteger o feto.
7 Essa lógica sustenta a hierarquização das condutas, prevenindo atrasos em intervenções necessárias e evitando cesarianas motivadas por alterações transitórias.
Inspiradas no modelo da emergência do trauma, consolidado pelo mnemônico ABCDE do
Advanced Trauma Life Support (ATLS) e depois atualizado pelo XABCDE, as professoras Melania Amorim e Leila Katz propuseram em 2011 o mnemônico ABCDEFG aplicado à eclâmpsia, adaptando a sequência clássica do ATLS (ABCDE) e integrando duas etapas obstétricas: F (Feto) e G (Gestação). Somente em 2018, o mnemônico de A a G, foi citado pela Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO), embora sem detalhamento como protocolo de execução.
8 Dessa forma, o presente artigo amplia, atualiza e operacionaliza esse mnemônico como protocolo integrado, com ênfase em segurança do paciente, comunicação efetiva e aplicabilidade em diferentes níveis de complexidade.
9MétodosFoi realizada uma revisão narrativa da literatura nas bases MEDLINE/PubMed e Biblioteca Virtual em Saúde (BVS), que inclui BIREME, SciELO e LILACS, com objetivo de construção do mnemônico como protocolo integrado. Foram incluídos estudo do tipo ensaios clínicos e revisões sistemáticas sobre anticonvulsivantes e desfechos maternos,
10,11 investigações sobre repercussões fetais pós‑convulsão e dinâmica do traçado,
12 revisões narrativas recentes sobre complicações maternas
6,7 e séries e estudos multicêntricos sobre morbimortalidade em diferentes contextos.
2,3,9A pesquisa foi guiada por perguntas desenvolvidas pelo mnemônico PICO (paciente, intervenção, comparação e outcomes): "em mulheres com eclâmpsia, o sulfato de magnésio (MgSO₄) intravenoso (IV), comparado a benzodiazepínicos ou fenitoína, reduz recorrência de convulsões, necessidade de ventilação e morte?"; "em hipertensão grave, quais agentes de primeira linha garantem controle rápido e seguro, sem hipotensão iatrogênica?"; e após a crise, alterações da FCF fetal são transitórias e revertem com a estabilização materna?".
Desenvolvimento do algoritmo e instrumentos de apoioA partir das âncoras (A–E para estabilização; e F–G para avaliação fetal e decisão obstétrica), foram elaborados instrumentos de apoio: quadros de preparo e monitorização do MgSO₄, metas pressóricas, esquemas anti‑hipertensivos, painel laboratorial e algoritmos de interrupção, utilizando as definições recomendadas (Tabela 1).
Ressalta-se que todas as recomendações consideraram recursos disponíveis no Brasil e podendo ser adaptadas a outras realidades: nifedipina via oral (VO) e hidralazina IV, como pilares no tratamento da hipertensão grave; preparo padronizado do MgSO₄ com antídoto imediato; e vigilância clínica estruturada.
Validação clínica e atualizaçãoO protocolo foi confrontado com a prática de equipes em pronto-atendimento e revisado por especialistas em medicina materno-fetal, anestesia obstétrica e terapia intensiva. Divergências foram resolvidas por consenso, priorizando segurança e exequibilidade. O documento é dinâmico, atualizado conforme novas revisões, ensaios e dados de implementação (tempos porta-magnésio e porta-controle pressórico, taxa de cesariana por FCF não tranquilizadora e eventos adversos). Cursos e treinamentos ministrados por Amorim e Katz seguem como plataforma de difusão e auditoria.
8,13O mnemônico ABCDEFGPropósito e racionalO mnemônico ABCDEFG organiza, em linguagem operacional, o atendimento inicial à eclâmpsia de forma tempo-dependente e centrada na segurança materno-fetal. Sua ideia é simples: estabilizar a mãe com avaliação primária rápida e reavaliações sucessivas (A–E) e, só então, avaliar o feto e deliberar a via/momento de interrupção (F–G). A sua construção segue o alfabeto, ABCDEFG (Figura 1):
A - Ajuda/Airway (vias Aéreas): proteção de vias aéreas e convocação da equipe com papéis definidos.
B - Breathing: avaliação do padrão respiratório e oxigenação titulada.
C - Circulation (Circulação): acesso venoso, hidratação cautelosa e vigilância de perfusão.
D - Disability (Prevenir Dano): avaliação neurológica dirigida e anticonvulsivante de escolha (MgSO₄).
E - Exame completo/Emergência hipertensiva/Exames: exame físico dirigido, tratamento imediato da hipertensão grave e painel laboratorial.
F - Feto: avaliação do bem-estar fetal após estabilização materna, reconhecendo alterações transitórias pós‑convulsão.
G - Gestação: decisão da via e do momento da interrupção por critérios obstétricos, evitando intervenções intempestivas
Princípios de uso: Execução paralela por equipe treinada (briefada), ciclos de reavaliação curtos, comunicação em voz alta e registro de tempos críticos. Exige prontidão de materiais, antídotos e metas simples, integrando-se a checklists e fluxogramas para reduzir omissões e variabilidade. |
Adaptação a diferentes cenários
Em locais com recursos limitados, priorizar o essencial: posicionamento lateral, aspiração, oxigênio, dois acessos venosos, MgSO₄ com antídoto à cabeceira, tratamento imediato da hipertensão e avaliação fetal após estabilização. Em centros de maior complexidade, incorporar monitorização avançada, exames de imagem, conforme critérios, e suporte de anestesia e unidade de terapia intensiva (UTI) obstétrica.
Aplicação prática do XABCDE na eclâmpsia
O mnemônico ABCDEFG foi criado antes da modificação do ATLS para XABCDE. Como a eclâmpsia não é primariamente hemorrágica, foi decidido manter a omissão do X, mas se recomenda uma rápida inspeção para traumas ou hemorragia pós‑parto (HPP). Após essa varredura, seguem-se: A e B: patência das vias aéreas, proteção contra aspiração e ventilação/oxigenação adequadas; C: dois acessos calibrosos, hidratação conservadora e vigilância hemodinâmica; D: avaliação neurológica e administração precoce de MgSO₄ IV; E: exame físico dirigido, tratamento imediato da hipertensão grave e exames laboratoriais prioritários. As etapas F e G (avaliação secundária) só devem ser acionadas após estabilização materna, evitando cesarianas motivadas por alterações fetais transitórias.12
Preparação da sala e distribuição de papéis
Antes da sequência, confirmar materiais (aspiração, oxigênio, máscara, cânulas, acesso venoso, bomba de infusão, MgSO₄, antídoto e esfigmomanômetro calibrado), definir funções (monitorização, drogas, aspiração, documentação, comunicação com neonatologia e exames de imagem) e revisar plano A–B–C caso seja necessária via aérea avançada.
Execução paralela e reavaliação contínua
O ABCDE deve ser realizado em paralelo, com papéis definidos e comunicação em voz alta. A via aérea, respiração e perfusão são reavaliadas em ciclos curtos, enquanto o MgSO₄, anti‑hipertensivos e exames são implementados sem interromper a vigilância clínica. Esse desenho reduz tempos críticos e prepara a transição ordenada para F e G.
O Passo-a-Passo (Etapas)
A - AIRWAY (VIAS AÉREAS) / AJUDA
O primeiro movimento é proteger a via aérea, manter sua patência e prevenir broncoaspiração desde o início da crise até o período pós‑ictal, enquanto a equipe é convocada e os papéis são definidos em voz alta. A liderança clínica aciona obstetrícia, anestesia com experiência em via aérea obstétrica, enfermagem de leito e, quando pertinente, neonatologia, distribuindo funções claras – quem monitora, quem aspira, quem registra tempos e quem comunica à sala de parto ou UTI – para reduzir omissões e encurtar tempos críticos.14,15
A segurança do leito deve ser imediata: decúbito lateral esquerdo, cabeça lateralizada, grades acolchoadas e afastamento de objetos rígidos. Evita-se contenção vigorosa durante a crise. O posicionamento lateral reduz o risco de aspiração e facilita drenagem de secreções enquanto a equipe organiza a sequência de cuidados.14
Encerrada a fase convulsiva, confirma-se a patência da via aérea de forma sistemática: verificar fonação, movimento de ar e esforço respiratório; aplicar manobras básicas de abertura (chin-lift e jaw-thrust); aspirar secreções sempre que presentes. Em rebaixamento de consciência, utilizar cânula orofaríngea adequada para manter patência e prevenir mordedura de língua. Não se deve introduzir objetos improvisados na boca, forçar abertura bucal com os dedos ou tentar posicionar cânula de Guedel em paciente consciente e alerta.15
A decisão por via aérea avançada não se adia quando os critérios estão presentes: incapacidade de proteger a via aérea, hipoxemia persistente, apneia, rebaixamento importante do nível de consciência (escala de Glasgow ≤8) ou crises recorrentes/refratárias. Na gestante, a probabilidade de via aérea difícil é maior — edema de mucosa, menor reserva de oxigênio e estômago cheio — por isso, a primeira passagem precisa ser a melhor. Alertar para um planejamento prévio por profissional treinado, com estratégia de resgate pronta, dispositivo supraglótico disponível e material para cricotireoidostomia de salvamento, quando necessário.15,16
A execução segura depende de checklist breve de via aérea obstétrica, incluindo equipamentos (aspirador, máscara e bolsa-válvula, cânulas de vários tamanhos, videolaringoscópio, dispositivo supraglótico e material para cricotireoidostomia), definição de papéis e plano de primeira passagem e de resgate. A monitorização contínua da saturação periférica de oxigênio (SpO₂), frequência cardíaca e PA deve ser iniciada na admissão e mantida durante toda a estabilização.14
Os "nuncas" do A:
• Nunca inserir objetos improvisados na boca da paciente durante a convulsão.
• Nunca forçar abertura da boca com os dedos ou usar cânula de Guedel em paciente consciente.
• Nunca atrasar a proteção da via aérea quando os critérios objetivos para intubação estiverem presentes.
• Nunca realizar múltiplas tentativas de intubação desorganizadas, sem plano de resgate definido.
• Nunca retirar a lateralização da cabeça ou negligenciar a segurança do leito.
• Nunca interromper a infusão do MgSO₄ para liberar a via para outras medicações.
B – BREATHING (RESPIRAÇÃO)Objetiva assegurar a ventilação e oxigenação adequadas no período pós‑ictal imediato, quando oscilações respiratórias são frequentes e o risco de hipoxemia é maior. A avaliação clínica é seriada, em ciclos curtos, observando frequência respiratória (FR), padrão ventilatório (amplitude, uso de musculatura acessória e pausas), expansibilidade torácica e ausculta pulmonar. Esse monitoramento repetido permite identificar deterioração tardia, decorrente de aspiração, depressão central ou fadiga, orientando o momento de escalonamento.
5,6A oxigenoterapia deve ser titulada, não automática: inicia-se por máscara não reinalante, ajustando o fluxo para manter SpO₂ ≥95%, reduzindo à medida que a paciente estabiliza. O objetivo é corrigir hipoxemia sem provocar hiperóxia sustentada, que pode trazer repercussões hemodinâmicas indesejáveis. A equipe deve registrar horários, metas e respostas, valorizando tendências mais do que valores isolados.
6Os gatilhos para suporte avançado são explícitos: queda persistente da saturação apesar de oxigênio titulado, aumento do trabalho respiratório, ventilação manifestamente inadequada ou sinais clínicos de aspiração (tosse inefetiva após episódio de vômito, estridor ou roncos úmidos persistentes, crepitações novas em bases pulmonares e hipoxemia progressiva não explicada por outros fatores). Diante desses achados, aciona-se prontamente a equipe responsável, seguindo protocolo institucional para suporte não invasivo ou intubação. Em paralelo, reavalia-se a etapa A, pois essa falha ventilatória pode refletir perda de proteção de via aérea, aspiração significativa ou necessidade de sedação controlada por recorrência convulsiva.
Alguns princípios são mandatórios: não hiperventilar sem indicação; não manter alto fluxo por inércia, sem reavaliações e desmame progressivo quando a meta de SpO₂ estiver sustentada; e não retardar o escalonamento diante de critérios objetivos. Na primeira hora, devem ser registrados intervalos seriados de SpO₂ e FR, integrando esses dados às decisões hemodinâmicas e neurológicas subsequentes.
6,16Os
"nuncas" do B:
• Nunca manter oxigênio em alto fluxo por inércia, sem reavaliações seriadas e ajuste conforme necessidade.
• Nunca hiperventilar a paciente sem indicação clínica.
• Nunca ignorar sinais de fadiga respiratória ou esforço ventilatório evidente.
• Nunca postergar o escalonamento quando SpO₂ <90% apesar de oxigênio suplementar.
• Nunca persistir apenas com máscara facial se houver critérios para via aérea avançada.
C – CIRCULATION (CIRCULAÇÃO)Nesta etapa a perfusão materna é sustentada, preparando a via de acesso para terapias críticas e organizando a vigilância hemodinâmica das primeiras horas, sempre com parcimônia hídrica e registro disciplinado. Aferir a PA com manguito adequado e padronizar o mesmo membro para medidas sequenciais reduz variabilidade. No pós‑ictal deve-se repetir as aferições em intervalos curtos, associando-as à avaliação clínica (perfusão periférica, tempo de enchimento capilar e nível de consciência), pois valores isolados podem ser enganosos.
5,6Os acessos venosos devem ser obtidos precocemente: dois periféricos calibrosos (16–18G) em membros superiores, fixados e testados, com bomba de infusão e rótulos padronizados. Sempre que possível, reservar uma via exclusivamente para o MgSO₄, evitando pausas e trocas que fragilizam a terapia, deixando a outra para as demais medicações e fluidos. Em situações de punção difícil, o acesso intraósseo umeral é alternativa segura e rápida.
5A estratégia de fluidos deve ser conservadora. O objetivo é manter perfusão com cristaloide isotônico em taxa basal baixa, ajustada pela clínica. Hipotensão sustentada exige busca da causa, como uso de anti‑hipertensivo, reflexo vasovagal e sangramentos, não realizando expansão automática. Ressalta-se que, em gestantes com pré‑eclâmpsia/eclâmpsia, a alteração da complacência vascular e a tendência à sobrecarga tornam a liberalidade de administrar volume perigosa, a prudência previne congestão e hipoxemia.
5,6,17A diurese deve ser monitorada por sonda vesical de demora, interpretada no contexto hemodinâmico e renal. A meta operacional é ≥0,5 mL/kg/h (ou 25–30 mL/h), funcionando como sinal de alerta. Oligúria persistente deve levar à reavaliação de volemia, perfusão e função renal, além de ajustes na infusão de MgSO₄.
5,17A organização das infusões é determinante para a segurança: toda solução deve ser rotulada com droga, concentração, taxa (mL/h e g/h), horário de início e dupla checagem de preparo. Evitar co-infusão em Y com soluções incompatíveis e planejar trocas sem interromper terapias críticas. Cada administração relevante deve ter registro de tempo e resultado (PA, frequência cardíaca, SpO₂ e diurese), permitindo calibrar a conduta e gerar indicadores de qualidade.
6Essa etapa se articula diretamente com as etapas B e E: ventilação adequada preserva a hemodinâmica e o controle pressórico só é seguro quando a circulação está estável e monitorada. Em qualquer piora, deve-se retomar as etapas A–B–C em reavaliações rápidas.
Os
"nuncas" do C:
• Nunca corrigir hipotensão empiricamente com grandes volumes sem investigar a causa.
• Nunca liberalizar fluidos em pacientes com pré‑eclâmpsia/eclâmpsia sem critério clínico, pelo risco de edema agudo de pulmão.
• Nunca utilizar a mesma via do MgSO₄ para infundir outras drogas, interrompendo a terapia.
• Nunca deixar de registrar horários, doses, taxas e respostas hemodinâmicas (ausência de rastreabilidade compromete a segurança).
• Nunca negligenciar a mensuração de diurese.
• Nunca ignorar sinais clínicos precoces de sobrecarga hídrica (dispneia e crepitações) ou instabilidade hemodinâmica.
D – DISABILITY/ PREVENÇÃO DE DANO (NEUROLÓGICO) / MgSO4O eixo desta etapa é inequívoco: cessar a crise, prevenir recorrências e proteger o cérebro materno, enquanto prossegue a estabilização sistêmica. O MgSO₄ é a terapia de escolha, comprovadamente superior ao diazepam e fenitoína na redução de novas convulsões e mortalidade materna. A administração deve ser imediata, logo após a crise, sem aguardar exames, com vigilância clínica de FR, reflexos tendíneos profundos e diurese.
4,8,18O
Collaborative Eclampsia Trial, 1995, consolidou a superioridade do MgSO₄. Revisões sistemáticas, posteriores, publicadas na biblioteca Cochrane confirmaram a efetividade e segurança frente ao diazepam, fenitoína e coquetel lítico.
4,8,17 Essa base sustenta protocolos simples e reproduzíveis: dose de ataque e manutenção, prevenção de toxicidade, preparo do antídoto e plano para recorrência.
Os principais esquemas terapêuticos clássicos são:
• Zuspan: ataque 4 g IV em 20–30 min; e manutenção 1 g/h IV.18
• Pritchard: ataque 4 g IV + 10 g intramuscular (IM) (5 g em cada glúteo); e manutenção 5 g IM a cada 4 h, condicionada a reflexos profundos presentes, FR adequada e diurese >25–30 mL/h.19
• Sibai: ataque 6 g IV em 20–30 min; e manutenção 2 g/h IV.20
O Instituto de Medicina Integral Prof. Fernando Figueira (IMIP) utiliza o regime de Sibai, com ataque de 6 g IV em 20–30 min e manutenção que varia de 1 g/h para pré‑eclâmpsia a 2 g/h para eclâmpsia (Tabela 2), quando foram verificadas recorrências da crise convulsiva acima do previsto pela literatura (10%) com a infusão de 1 g/h. A duração deve ser de 24h após o parto ou última crise convulsiva.
5,6 Sugerimos o esquema IV, pois a revisão sistemática publicada na biblioteca Cochrane, 2023, não demonstrou superioridade inequívoca entre os diferentes esquemas de MgSO₄, mas destacou limitações metodológicas dos estudos.
21 Ainda assim, o regime IV contínuo é preferido por vários motivos:
• Início de ação previsível e possibilidade de controle da dose (interrupção ou redução imediata diante de sinais de toxicidade, inviável em grandes depósitos IM).
• Monitorização mais segura, facilitando ajustes conforme clínica.
• Menor risco de complicações locais (dor intensa, abscesso e hematoma glúteo), especialmente relevantes em plaquetopenia ou uso de anticoagulantes.
• Contraindicação do uso IM em síndrome HELLP com plaquetopenia.
• Menor chance de erro de preparo/dose (padronização em bomba de infusão, com rótulo completo e linha exclusiva).
• Exequibilidade no contexto do serviço, que dispõe de bombas, equipe treinada e logística para monitorização contínua.
Reconhece-se que a literatura ainda não demonstrou superioridade inequívoca de um regime sobre outro nos desfechos críticos. Novos ensaios clínicos seriam necessários para definir o papel do esquema IM, que pode ter espaço em situações de transporte sem bomba de infusão ou quando há necessidade de restringir hidratação, desde que respeitadas as contraindicações.
Foram também testadas variações da duração da terapia (dose única, 6h, 12h, 24h ou ajuste pela diurese),
17,22 mas o maior e mais robusto estudo, o
Eclampsia Trial, utilizou MgSO₄ por 24h. Assim, não há justificativa clínica para abreviar um esquema que permanece sendo o mais estudado.
17,23Durante a infusão do MgSO₄, a paciente deve ser acompanhada com parâmetros simples e contínuos que sugerem intoxicação, não havendo necessidade de dosar o magnésio sérico para monitorização:
24• Respiratória: FR seriada; e SpO₂ contínua.
• Neurológica: reflexos tendíneos profundos (patelar/bicipital) presentes.
• Renal: diurese ≥ 25–30 mL/h (ou ≥0,5 mL/kg/h).
• Sinais de toxicidade: perda de reflexos em níveis elevados; depressão respiratória com níveis ainda mais altos; e parada cardíaca em níveis extremos.5,6
• É importante conhecer que diante de sinais de toxicidade deve-se:
• Suspender o MgSO₄.
• Oxigênio/ventilação suporte conforme necessidade (se depressão ou parada respiratória).
• Administrar antídoto (gluconato de cálcio 10%, 10mL (1 g) IV lento em 2–3 min, com monitorização cardiorrespiratória).
Manejo da recorrência de convulsão sob MgSO4₄A maioria das recorrências, em se tratando da crise convulsiva pura (sem hemorragia intracraniana) responde à nova dose do MgSO₄. Ressalta-se que a sedação e via aérea avançada devem ser consideradas precocemente nos casos refratários ou com risco de aspiração/hipoxemia, devido à maior chance de hemorragia por convulsão secundária (não perder tempo nesses casos fazendo hidantoína). Assim, deve-se:
• Confirmar se a dose de ataque foi completa e se a infusão de manutenção está ativa e correta.
• Re-dose imediata: 3 g IV em 5–10 min.
• Recorrência ou persistência: hidantoína (10 mg/kg) IV e avaliação com anestesia para sedação, intubação e ventilação, quando indicado. Se houver resposta à dose inicial de hidantoína, fazer manutenção IV.
• Em estado de mal epiléptico ou deterioração respiratória/hemodinâmica: sedação de sequência rápida conforme protocolo institucional, priorizando proteção de via aérea e controle hemodinâmico, com manutenção do MgSO₄ após estabilização.
5,6Ajustes em disfunção renal/oligúriaO MgSO₄ é uma droga de excreção renal e a eclâmpsia muitas vezes se associa a deterioração da função renal. Desta forma, a dose de ataque deve ser sempre mantida, mas ajustes podem ser necessários na manutenção (Tabela 2):
• Oligúria ou oligo/anúria (<25–30 mL/h): suspender a manutenção.
• Diurese presente, mas creatinina elevada:
* <1,5 mg/dL: fazer manutenção normal (eclâmpsia = 2 g/h).
* 1,5–2,4 mg/dL: fazer metade da dose de manutenção (eclâmpsia = 1 g/h).
* ≥2,5 mg/dL: não fazer.
Os "nuncas" do D:
• Nunca interromper a infusão do MgSO₄ para liberar a via a outras drogas.
• Nunca administrar re‑doses sucessivas de MgSO₄ sem seguir o fluxo do serviço: re‑dose única de 3 g IV; se persistir, hidantoína e avaliação para intubação orotraqueal (IOT).
• Nunca ajustar taxa de infusão sem checar respiração, reflexos tendíneos profundos e diurese.
• Nunca afastar o antídoto (gluconato de cálcio) do leito.
• Nunca utilizar esquema IM em pacientes com plaquetopenia ou síndrome HELLP, pelo risco de hematoma/abscesso.
E - EMERGÊNCIA HIPERTENSIVA, ESTABILIZAÇÃO E EXAMES
A hipertensão grave na eclâmpsia [pressão arterial sistólica (PAS) ≥160 mmHg e/ou diastólica (PAD) ≥110 mmHg] é uma emergência tempo-dependente que deve ser tratada de imediato, sem aguardar "confirmações" adicionais nem o término da infusão da dose de ataque do MgSO₄. A administração do anti‑hipertensivo e do MgSO₄ deve ser simultânea. A meta nas primeiras horas é reduzir a PA em aproximadamente 15% a 25% e mantê-la com a PAS entre 130–150 mmHg e PAD entre 80–100 mmHg, evitando quedas abruptas que comprometam perfusão cerebral e uteroplacentária.2,5
O manejo começa pela aferição correta: manguito adequado ao braço, membro padronizado e registro do horário de cada medida. Diante de valores graves, o tratamento é iniciado imediatamente, em paralelo às demais medidas. No IMIP, utilizam-se nifedipina VO de liberação imediata e hidralazina IV (labetalol não disponível no Brasil). Em qualquer esquema, vale a regra de uma mudança por vez: ajustar, medir, esperar o intervalo de resposta e só então decidir novo passo (Tabela 3).2,5
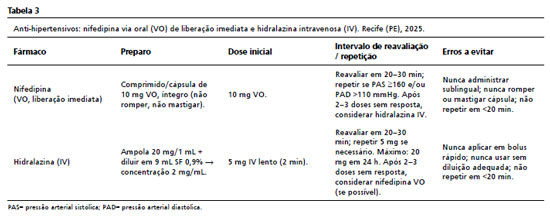
O controle pressórico deve ser acompanhado de medidas que reduzem descarga adrenérgica e complicações: ambiente calmo, posicionamento lateral com cabeceira elevada ou desvio uterino, além de antieméticos e analgesia, quando indicados. A hidratação segue a parcimônia da etapa C, com balanço hídrico e metas de diurese. Em 10, 30 e 60 min registrar PA, sintomas-alvo e resposta às intervenções. A comunicação deve seguir alça fechada (ordem explícita,
read-back, confirmação, registro de horário e resultado).
25 A segurança depende de vigilância clínica e documentação contínua, com atenção a sinais de hipotensão iatrogênica e ajuste com a resposta pressórica.
Os exames prioritários incluem hemograma com plaquetas, provas de função hepática [aspartato aminotransferase (TGO/AST), alanina aminotransferase (TGP/ALT), desidrogenase lática (DHL) e bilirrubinas], haptoglobina para investigação de hemólise, ureia, creatinina, eletrólitos, ácido úrico e proteinúria (amostra isolada com relação proteína/creatinina) (Tabela 4). Complementam-se com o eletrocardiograma (ECG), quando indicado, e radiografia de tórax, na suspeita de aspiração ou edema agudo de pulmão. A fundoscopia é indicada em casos de amaurose persistente, auxiliando no diagnóstico diferencial de descolamento de retina e cegueira cortical. A neuroimagem [tomografia computadorizada (TC) ou ressonância magnética (RM)] é recomendada diante de coma prolongado, déficits focais, cefaleia em trovoada, amaurose persistente, crises recorrentes apesar do MgSO₄ ou suspeita de hemorragia intracraniana/trombose venosa cerebral, com objetivo de identificar lesões estruturais e encefalopatia posterior reversível (Tabela 4).
5 A eclâmpsia é uma condição que exige cuidados intensivos. O manejo adequado não se concebe sem a perspectiva de UTI em algum momento da evolução clínica. A necessidade de encaminhamento pode surgir em diferentes etapas: nas fases de via aérea e respiração, quando há necessidade de intubação ou suporte ventilatório; na circulação, diante de instabilidade hemodinâmica ou disfunção renal; no componente neurológico, em casos de crises recorrentes ou estado de mal epiléptico; e no controle da hipertensão, quando refratária ao arsenal inicial. Mesmo após a interrupção da gestação, o risco de instabilidade no puerpério imediato justifica permanência em terapia intensiva.
O ponto central é que toda paciente com eclâmpsia deve ser admitida ou transferida para UTI, seja logo no início, diante de complicações graves, seja após a estabilização inicial, para garantir vigilância contínua e suporte avançado. O local ideal é sempre aquele capaz de prover monitorização ininterrupta, equipe especializada e resposta rápida a deteriorações abruptas, condições inerentes ao quadro de eclâmpsia.
Com a pressão controlada e a estabilidade clínica assegurada, conclui-se o atendimento primário e inicia-se a avaliação secundária, que na eclâmpsia se concentra nas etapas F (feto) e G (gestação). Essa hierarquização evita intervenções intempestivas motivadas por alterações fetais transitórias pós‑convulsão e mantém o foco na recuperação materna e proteção fetal.
2,5Nessa etapa, o ATLS
27 utiliza o mnemônico AMPLE (
Allergies, Medications, Past Medical History, Last Meal or Oral Intake and Events Leading to Injury) para coletar o histórico clínico essencial e, em gestantes, modificamos para CODE (Complicações da gestação, história Obstétrica, Data estimada e Eventos adicionais). Aqui, propomos uma simplificação intencional: restringir a avaliação secundária às etapas F e G, refletindo a prioridade clínica da eclâmpsia.
Por fim, destaca-se que a etapa E deve ocorrer em paralelo ao MgSO₄ (D) e às medidas respiratórias (B), sempre com parcimônia hídrica (C), reforçando que a separação entre letras é apenas didática: tudo deve ser executado ao mesmo tempo.
Os "nuncas" do E:• Nunca postergar o início do anti‑hipertensivo diante de hipertensão grave.
• Nunca usar nifedipina sublingual ou manipular cápsula/comprimido.
• Nunca administrar outras drogas em sequência rápida sem respeitar o tempo de resposta-dose.
• Nunca alternar múltiplos agentes ao mesmo tempo (uma mudança por vez).
F – FETO (Avaliação Fetal)Nesta etapa destaca-se que o princípio é "primeiro a mãe". A melhor intervenção fetal, imediatamente após a convulsão, é a reanimação materna completa. A perfusão útero-placentária é dependente da estabilidade hemodinâmica e ventilatória da gestante. A hipoxemia, hipertensão grave não controlada, taquissistolia e posicionamento materno inadequado reduzem o fluxo e explicam as alterações típicas da FCF que se seguem ao episódio convulsivo. Ao priorizar vias aéreas e respiração (A–B), circulação (C), MgSO₄ (D) e controle pressórico (E), restituímos o substrato fisiológico do feto e, na maioria dos casos, o traçado cardiotocográfico (CTG) se recompõe em minutos a poucas horas.
5,10Com a paciente estabilizada e a pressão dentro da faixa operacional, a avaliação fetal ganha foco. O padrão mais frequente após a crise convulsiva: bradicardia inicial, seguida de taquicardia compensatória e variabilidade da FCF reduzida, frequentemente acompanhadas de desacelerações transitórias. Esse conjunto tende a regredir à medida que se asseguram oxigênio titulado, controle da hipertensão, correção da taquissistolia e posicionamento lateral materno. O objetivo nesta fase é documentar detalhadamente a recuperação com marcos temporais (minuto que ocorreu a convulsão, início e término da bradicardia fetal, medidas adotadas, momento em que surgiu a taquicardia fetal e o tempo até a normalização da variabilidade da FCF). Isto evita condutas precipitadas baseadas em recortes isolados imediatamente pós‑convulsão.
10Devem ser adotados checkpoints: registrar a hora da crise, a evolução minuto a minuto da FCF e as respostas às medidas. A monitorização pode ser contínua (cardiotocografia) nas primeiras horas ou, na falta dela, intermitente seriada a cada 15 min, desde que a reanimação materna tenha prioridade.
A bradicardia fetal sustentada por mais de 10 a 15 min, apesar da reanimação materna adequada, eleva a suspeita de descolamento prematuro de placenta normalmente inserida (DPPNI), devendo se observar outros sinais clínico.
9 Quando o descolamento é significativo, o traçado CTG pode deixar de mostrar recuperação, mantendo bradicardia ou evoluindo para taquicardia prolongada e variabilidade mínima, um padrão que sugere sofrimento fetal persistente. É importante salientar que o diagnóstico de DPPNI, nesse contexto, é sobretudo clínico, pois a ultrassonografia muitas vezes não o identifica.
Na ausência de achados persistentes de comprometimento fetal, prevalece a expectativa de normalização progressiva e a interrupção da gestação volta a ser guiada por critérios obstétricos, não pela reação transitória ao evento convulsivo.
5,10A comunicação com a equipe deve obedecer à lógica de alça fechada: anunciar o padrão esperado pós‑convulsão, declarar o limiar objetivo para DPPNI e marcar o próximo checkpoint ("reavaliar em 10 min"). Essa prática protege contra duas situações igualmente arriscadas: adiar uma intervenção necessária quando a recuperação não ocorre no tempo previsto ou precipitar uma cesariana diante de alterações que eram apenas expressão transitória do estado materno.
Alerta do F: primeiro a mãe!• Mesmo que exista indicação de cesárea, a menos que seja urgente (DPPNI), sempre estabilizar a mãe primeiro (E)
• Não precipitar cesariana com base em CTG alterado imediatamente após a convulsão.
• A própria alteração da FCF pode melhorar com a reanimação materna.
• Garantir reanimação materna completa (A–E) antes de concluir que há sofrimento fetal sustentado.
• Manter marcos temporais no registro: tempo desde a convulsão, momento em que a bradicardia começou e quando cessou, medidas realizadas e resposta.
G – GESTAÇÃO (VIA E MOMENTO DA INTERRUPÇÃO)A eclâmpsia é indicação de interrupção da gestação, mas não de retirada fetal imediata. A sequência é deliberada: primeiro a estabilização materna completa (A–E), depois a reavaliação fetal (F) e, por fim, a decisão obstétrica proporcional ao risco. Sempre que possível, aguarda-se um intervalo aproximado de uma hora após a última crise, permitindo recuperação materna e reversão das alterações fetais transitórias pós‑convulsão.
A via de nascimento não é cesariana por definição. A decisão deve sempre se apoiar em critérios obstétricos objetivos, levando em consideração as condições maternas e fetais. O parto vaginal deve ser a via preferencial sempre que houver viabilidade clínica e obstétrica, por oferecer menor risco de complicações anestésicas, hemorrágicas e infecciosas, além de favorecer a recuperação materna e reduzir intervenções desnecessárias.
6,27A cesariana, nesse contexto, deve ser reservada a situações de real indicação, como sofrimento fetal persistente não responsivo à estabilização materna, DPPNI, hemorragia significativa, apresentações anômalas ou em casos de idade gestacional precoce (<32 semanas) com colo desfavorável e feto viável (tempo de indução até o parto pode ser excessivamente longo para garantir o nascimento com segurança), mas a decisão deve ser individualizada. Alterações persistentes da CTG ou dopplervelocimetria com diástole na artéria umbilical zero ou reversa também são indicação de cesariana, mas não de urgência, estabilização materna é necessária.
A gestante é considerada estável para decisão do momento da interrupção quando: apresenta consciência em recuperação compatível, proteção de via aérea garantida, oxigenação adequada sob monitorização, convulsões controladas com manutenção do MgSO₄, pressão arterial estabilizada (PAS 130–150 mmHg e PAD 80–100 mmHg), diurese mensurada e documentação clínica completa. A partir desse marco, a avaliação obstétrica retoma centralidade.
Escolha da via de nascimentoEstudos observacionais indicam que a indução do parto e o parto vaginal podem ser alcançados com resultados aceitáveis em casos de eclâmpsia e dois ensaios clínicos randomizados demonstraram que o parto normal é factível e a cesariana não melhora os desfechos maternos e perinatais.
27,28 A revisão sistemática publicada na biblioteca Cochrane de pré‑eclâmpsia também sustenta que não há evidência de superioridade da cesariana planejada, o que reforça a prática obstétrica de preferir parto vaginal sempre que as condições maternas e fetais permitirem.
28Quando o colo é favorável e a apresentação for cefálica com feto vivo, recomenda-se a indução ou condução do parto vaginal, com analgesia adequada e vigilância materno-fetal contínua. No caso de feto morto, o parto normal permanece a via de nascimento mais indicada. Se o colo é desfavorável e não há urgência, pode-se considerar preparo cervical. A cesariana é reservada a situações de risco desproporcional de aguardar: sofrimento fetal persistente não responsivo à reanimação materna; DPPNI; hemorragia grave; apresentações anômalas; e cicatriz uterina que contraindica a indução ou inviabilidade de indução dentro do tempo clínico disponível.
5Para indução do trabalho de parto, métodos combinados, como balão mais misoprostol ou balão mais prostaglandina ou balão mais ocitocina, são preferíveis quando tecnicamente disponíveis, pois distribuem os efeitos maturativos do colo e reduzem riscos de hiperestimulação uterina.
29Durante a fase ativa e, sobretudo, no período expulsivo, deve-se manter vigilância fetal rigorosa, seja por ausculta intermitente estruturada ou por CTG, quando disponível, associada a analgesia adequada e oxigenação materna constante. O objetivo é reduzir o risco de descompensação súbita tanto para a mãe quanto para o feto.
30No contexto da eclâmpsia, recomenda-se não apenas intervir diante de sinais de comprometimento, mas também evitar esforços expulsivos excessivos que possam desencadear novos picos hipertensivos ou recorrência de convulsões. Assim, a conduta é antecipar o nascimento sempre que o período expulsivo se prolongar, utilizando vácuoaspiração ou fórceps de alívio, ainda que a vitalidade fetal esteja preservada. A monitorização materna com SpO₂ pode também indicar o parto instrumental se houver queda da saturação (<95%).
31Quanto à posição, a paciente pode adotar aquela de sua preferência: se estável, pode caminhar ou optar por parir em posição vertical, desde que sob monitorização contínua e adequada. Essa liberdade, aliada ao cuidado em abreviar o expulsivo, quando necessário, faz parte da estratégia para garantir segurança materna e fetal.
A analgesia de parto tem papel essencial no controle da dor e na redução da descarga adrenérgica, contribuindo para a estabilização hemodinâmica materna. As técnicas neuraxiais são preferidas quando não há contraindicações, como plaquetopenia significativa (plaquetas <70.000/mm³), coagulopatia ou alteração do nível de consciência. Quando essas condições impedem seu uso, (plaquetopenia grave, paciente sedada e ventilada ou sob anestesia geral), recorrem-se a técnicas alternativas não neuraxiais, sempre com vigilância multiprofissional.
Cuidados pós‑partoNo puerpério imediato, a manutenção do MgSO₄ por 24h após o parto ou após a última convulsão, continua mandatória, junto com o controle pressórico, balanço hídrico conservador e vigilância respiratória e neurológica. Paciente deve permanecer em UTI obstétrica pelo menos 72h e a transferência para cuidados semi-intensivos e posterior alta só deve ocorrer quando critérios objetivos de estabilidade forem cumpridos e documentados.
DiscussãoO manejo da eclâmpsia exige rapidez, precisão e cooperação multiprofissional. Nesse contexto, ferramentas que organizem a assistência tornam-se estruturantes. O
checklist elaborado pela
American College of Obstetricians and Gynecologists (ACOG) é importante,
29 mas apresenta limitações: não hierarquiza etapas e sua incorporação em situações de alta urgência é difícil. Estudos de implementação mostram que checklists aumentam a taxa de execução de condutas críticas, mas seu impacto depende diretamente do treinamento e da familiaridade da equipe. Nesse cenário, a adaptação de um modelo consolidado, como o ATLS, surge como estratégia mais efetiva para o contexto obstétrico.
O mnemônico ABCDEFG (SAVE) traz clareza e linearidade à sequência de avaliação, reduzindo falhas associadas a estresse, fadiga e sobrecarga cognitiva. A proposta não engessa, mas fornece uma estrutura mental que previne omissões e permite execução dinâmica e simultânea de etapas, desde que haja equipe treinada e comunicação eficiente. A avaliação deve ser contínua e cíclica, ajustando intervenções conforme a resposta clínica.
A adaptação ao contexto obstétrico é fundamental: enquanto no trauma priorizam-se intervenções invasivas imediatas, na eclâmpsia a ênfase recai sobre proteção de vias aéreas e respiração, controle da hipertensão e prevenção de novas convulsões. A alocação da avaliação fetal (F) destaca a prioridade que estabilizar a mãe é a melhor forma de proteger o feto. O ABCDEFG funciona, portanto, como um "trilho do raciocínio clínico", sem substituir o juízo situacional da equipe.
A menção ao mnemônico pode sugerir sequência rígida, mas a prática mostra que a avaliação deve ser simultânea, dinâmica e rápida. No trauma, A–B–C–D podem ser inferidos em poucos segundos, bastando breve interação verbal com o paciente.
27 Em obstetrícia, a analogia é válida: se a gestante responde adequadamente, é improvável que haja falha crítica imediata, mas a avaliação primária deve ser completada. O processo é iterativo, repetindo-se em ciclos para monitorar a resposta e identificar novas instabilidades.
A padronização da comunicação é outro pilar. A alça fechada reduz erros, encurta tempos críticos e garante rastreabilidade das decisões. Ela sustenta o manejo em todos os pontos do protocolo: nomeação de papéis em A, metas de oxigenação em B, acesso e balanço hídrico em C, dose e manutenção do magnésio em D, metas pressóricas e exames em E, checkpoints fetais em F e decisão obstétrica em G. O
debriefing quente, logo após a estabilização, permite síntese imediata e compromissos de melhoria, enquanto o
debriefing frio, em 24–72 h, revisa indicadores, identifica causas-raiz e orienta ajustes de protocolo.
O ABCDEFG só se consolida quando incorporado como rotina institucional. O
bundle organiza-se em quatro eixos: prontidão (recursos disponíveis e cartazes com algoritmos), reconhecimento (gatilhos explícitos de triagem), resposta (execução paralela A–E e, depois, F–G, sempre com comunicação estruturada) e aprendizagem (simulações, auditoria e
debriefings regulares).
Embora concebido para a eclâmpsia, o modelo pode ser aplicado a outros cenários de instabilidade materna, inclusive quando o diagnóstico ainda não está definido na admissão. A sequência ajuda a identificar rapidamente determinantes críticos e direcionar condutas imediatas. No trauma obstétrico, o ATLS permanece referência,
25 mas o ABCDEFG o complementa, adaptando-o às particularidades da gestação. Já em emergências clínicas, como hemorragia pós‑parto, sepse puerperal e insuficiência respiratória aguda, o mnemônico organiza a abordagem e uniformiza a linguagem entre equipes, reduzindo omissões e falhas de comunicação.
Além do benefício operacional, há o potencial educativo: mnemônicos favorecem retenção de conhecimento e execução segura de condutas, enquanto protocolos estruturados estimulam a comunicação multiprofissional e reduzem falhas decorrentes da fragmentação do cuidado, um dos principais fatores associados a desfechos adversos.
Considerações finaisMais de três décadas após o
Eclampsia Trial, que consagrou o MgSO₄ como terapia padrão para prevenção e tratamento das crises, persistem falhas graves na prática clínica. Em muitos serviços, mulheres continuam a morrer não por ausência de evidência científica, mas por falhas evitáveis na sua aplicação: não administração do fármaco mesmo diante de indicação clara, erros de dose, ausência de monitorização clínica após a infusão e atrasos inaceitáveis no início do tratamento.
Esses achados evidenciam que não basta acumular evidência científica robusta: é preciso traduzi-la em protocolos simples, aplicáveis e reproduzíveis, que reduzam a variabilidade, orientem decisões rápidas e sustentem a comunicação entre equipes em cenários de extrema pressão.
É diante desse desafio que propomos o mnemônico ABCDEFG – uma adaptação obstétrica inspirada no ATLS, que organiza a lógica de atendimento, hierarquiza prioridades e cria uma linguagem comum para situações críticas. Não se trata de um exercício didático isolado, mas de uma estratégia concreta para salvar vidas maternas e fetais, transformando conhecimento consolidado em prática clínica segura, ágil e reprodutível.
Referências1. Rede Brasileira de Estudos sobre Hipertensão na Gravidez (RBEHG). Pré-eclâmpsia: Protocolo Assistêncial 2025. São Paulo: RBEHG; 2025. [acesso em 2025 Set 11]. Disponível em:
https://rbehg.com.br/wp-content/uploads/2025/04/Protocolo-RBEHG-2025-PDF-2.pdf2. Abalos E, Cuesta C, Grosso AL, Chou D, Say L. Global and regional estimates of preeclampsia and eclampsia: a systematic review. Eur J Obstet Gynecol Reprod Biol. 2013; 170 (1): 1–7.
3. Say L, Chou D, Gemmill A, Tunçalp Ö, Moller AB, Daniels J,
et al. Global causes of maternal death: a WHO systematic analysis. Lancet Glob Health. 2014; 2 (6): e323–33.
4. World Health Organization (WHO). WHO recommendations for prevention and treatment of pre‑eclampsia and eclampsia. Geneva: WHO; 2011. [
Internet]. [acesso em 2025 Set 11]. Disponível em:
https://www.who.int/publications/i/item/97892415483355. Sibai BM. Diagnosis, prevention, and management of eclampsia. Obstet Gynecol. 2005; 105 (2): 402–10.
6. Bartal MF, Sibai BM. Eclampsia in the 21
st century. Am J Obstet Gynecol. 2022; 226 (2S): S1237-53.
7. Ramos JGL, Martins‑Costa SH, Sass N. Eclampsia in Brazil in the 21
st century. Rev Bras Ginecol Obstet. 2022; 44 (7): 637-9.
8. Katz L, Haddad S, Coutinho I, Parpinelli MA. Atendimento inicial à eclampsia. São Paulo: Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO); 2018. [
Internet]. [acesso em 2025 Set 11]. Disponível em:
https://www.febrasgo.org.br/pt/noticias/item/329-atendimento-inicial-a-eclampsia9. Flávio‑Reis VHP, Pessôa-Gonçalves YM, Barbosa AC, Desidério CS, Rodrigues WF, Oliveira CJF. Maternal deaths caused by eclampsia in Brazil between 2000 and 2021. Rev Bras Ginecol Obstet. 2024; 46: e‑rbgo65.
10. The Magpie Trial Collaborative Group. Do women with pre‑eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo‑controlled trial. Lancet. 2002; 359 (9321): 1877‑90.
11. Duley L, Gülmezoglu AM, Henderson‑Smart DJ, Chou D. Magnesium sulphate and other anticonvulsants for women with pre‑eclampsia. Cochrane Database Syst Rev. 2010; 11: CD000025.
12. Ambia AM, Wells CE, Yule CS, McIntire DD. Fetal heart rate tracings associated with eclamptic seizures. Am J Obstet Gynecol. 2022; 227 (4): 622.e1‑622.e6.
13. Barros JF, Amorim MM, Costa DG, Katz L. Factors associated with severe maternal outcomes in patients with eclampsia in an obstetric intensive care unit:a cohort study. Medicine. 2021; 100 (38): e27313.
14. Mushambi MC, Kinsella SM, Popat M, Swales H, Ramaswamy KK, Winton AL,
et al; Obstetric Anaesthetists' Association; Difficult Airway Society. Obstetric Anaesthetists' Association and Difficult Airway Society guidelines for the management of difficult and failed tracheal intubation in obstetrics. Anaesthesia. 2015; 70 (11): 1286‑306.
15. Frerk C, Mitchell VS, McNarry AF, Mendonça C, Bhagrath R, Patel A,
et al. Difficult Airway Society 2015 guidelines for unanticipated difficult intubation in adults. Br J Anaesth. 2015; 115 (6): 827‑48.
16. Silva WA, Pinheiro AM, Lima PH, Malbouisson LMS. Renal and cardiovascular repercussions in preeclampsia and impact on fluid management. Braz J Anesthesiol. 2021; 71 (4): 421‑8.
17. The Eclampsia Trial Collaborative Group. Which anticonvulsant for women with eclampsia? Evidence from the Collaborative Eclampsia Trial. Lancet. 1995; 345 (8963): 1455‑63.
18. Zuspan FP. Treatment of severe preeclampsia and eclampsia. Clin Obstet Gynecol. 1966; 9 (4): 954‑72.
19. Pritchard JA, Cunningham FG, Pritchard SA. The use of the magnesium ion in the management of eclamptogenic toxemias. Surg Gynecol Obstet. 1955; 100 (2): 131‑40.
20. Sibai BM, Graham JM, McCubbin JH. A comparison of continuous intravenous and intramuscular magnesium sulfate regimens in preeclampsia. Am J Obstet Gynecol. 1984; 150 (6): 728‑33.
21. Diaz V, Long Q, Oladapo OT. Alternative magnesium sulphate regimens for women with pre‑eclampsia and eclampsia. Cochrane Database Syst Rev. 2023; 10 (10): CD007388.
22. Beyuo TK, Lawrence ER, Kobernik EK, Oppong SA. A novel 12‑hour versus 24‑hour magnesium sulfate regimen in the management of eclampsia and preeclampsia in Ghana (MOPEP Study): a randomized controlled trial. Int J Gynaecol Obstet. 2022; 159 (2): 495‑504.
23. Shaheen RS, Ismail RA, Salama EY, Korini SM, Elsaeidy AS. Efficacy and safety of 12‑hour versus 24‑hour magnesium sulfate in the management of pre‑eclampsia and eclampsia:a systematic review and meta‑analysis. BMC Womens Health. 2024; 24: 421.
24. Shennan A, Duley L, Magee L, Hall D, Brown M, Chappell L,
et al. FIGO good practice recommendations on magnesium sulfate administration for pre‑eclampsia and eclampsia. Int J Gynaecol Obstet. 2021; 152 (1): 133‑5.
25. Wu N, Li W, Huang R, Jiang H. Effect of simulation‑based training workshop on obstetric emergency team collaboration and communication: a mixed study. Front Med (Lausanne). 2024; 11: 1282421.
26. Committee on Trauma. Advanced Trauma Life Support (ATLS). 11
th ed. Chicago: American College of Surgeons; 2025.
27. Seal SL, Ghosh D, Kamilya G, Mukherji J, Hazra A, Garain P. Does route of delivery affect maternal and perinatal outcome in women with eclampsia? A randomized controlled pilot study. Am J Obstet Gynecol. 2012; 206 (6): 484.e1‑484.e7.
28. Amorim MMR, Katz L, Ávila MB, Albuquerque RM, Souza AS, Faúndes A. Planned caesarean section versus planned vaginal birth for severe pre‑eclampsia. Cochrane Database Syst Rev. 2017; 10: CD009430.
29. Nomura RMY, Nakamura‑Pereira M, Brizot ML, Trapani A Jr, Paro HBM, Rosas CF,
et al. Misoprostol use in obstetrics: Number 6 – June 2023. Rev Bras Ginecol Obstet. 2023; 45 (6): 356‑67.
30. Amorim MMR, Katz L, Barros AS, Almeida TSF, Souza ASR, Faúndes A. Maternal outcomes according to mode
Contribuição dos autoresAmorim MMR: conceitualização, metodologia, administração do projeto, supervisão, redação, revisão e edição do manuscrito. Katz L: conceitualização, validação, supervisão; redação, revisão e edição do manuscrito. Albuquerque MA: curadoria de dados, investigação, visualização, redação do manuscrito. Brito JC: investigação, validação, redação, revisão e edição do manuscrito. Cunha ACMC, Souza ASR: visualização, redação, revisão e edição do manuscrito. Todos os autores aprovaram a versão final do artigo e declaram não haver conflitos de interesses.
Disponibilidade de DadosTodo o conjunto de dados que dá suporte aos resultados deste estudo foi publicado no próprio artigo.
Recebido em 10 de Outubro de 2025
Versão final apresentada em 15 de Outubro de 2025
Aprovado em 16 de Outubro de 2025
Editor Associado: Lygia Vanderlei
 ; Anna Catharina Carneiro da Cunha1
; Anna Catharina Carneiro da Cunha1 ; Marina Amorim Albuquerque3
; Marina Amorim Albuquerque3 ; Josikwylkson Costa Brito4
; Josikwylkson Costa Brito4 ; Alex Sandro Rolland Souza2,5,6
; Alex Sandro Rolland Souza2,5,6 ; Leila Katz2,5
; Leila Katz2,5