RESUMO
INTRODUÇÃO: a triagem neonatal para fibrose cística deve contribuir para diagnóstico precoce e melhor prognóstico da doença. O estudo é uma série de casos com lactentes submetidos à triagem, porém com diagnóstico tardio da doença.
DESCRIÇÃO: quatorze crianças foram incluídas; oito (57,1%) com triagem falso-negativo e seis (42,9%) com erros processuais na triagem neonatal. Duas amostras foram coletadas tardiamente, sendo incorretamente classificadas como negativas e quatro lactentes com triagem positiva não foram localizados, por erros na busca ativa. Confirmou-se o diagnóstico da fibrose cística com idade mediana (IIQ) de 5,3 (4,2-7,4) meses. O Comprometimento nutricional precoce foi o sinal clínico mais prevalente ao diagnóstico, presente em 78,6% das crianças. Os Z escores médios (SD) do peso para altura e altura para idade foram -3,46 (0,84) e -3,99 (1,16), respectivamente. Metade das crianças teve síndrome de Pseudo-Bartter e 42,9% dificuldade respiratória. Doze crianças (85,7%) precisaram hospitalização com tempo mediano de permanência de 17 dias.
DISCUSSÃO: a triagem neonatal para fibrose cística apresentou falhas, desde testes falso-negativos, coletas incorretas, até problemas com a busca ativa. Entretanto, o diagnóstico ágil é essencial e os profissionais de saúde devem reconhecer os sintomas e sinais precoces da doença, mesmo quando a triagem neonatal não for satisfatória.
Palavras-chave:
Fibrose cística, Triagem neonatal, Política pública de saúde, Diagnóstico tardio, Erro diagnóstico
ABSTRACT
INTRODUCTION: cystic fibrosis newborn screening must enable its earlier diagnosis, which may enhance outcomes. This study was a series case of delayed-diagnosis children submitted to cystic fibrosis newborn screening.
DESCRIPTION: fourteen children were included; eight (57.1%) were due to false-negative screening, while six (42.9%) were due to processing errors. Two samples collected after 30 days of life were incorrectly classified as negative, and four infants with a positive test could not be located due to screening processing errors. Cystic fibrosis diagnosis was confirmed at a median (IQR) age of 5.3 (4.2-7.4) months. Poor nutritional status was the most prevalent clinical sign at diagnosis, being present in 78.6% of infants. The mean (SD) weight-for-length and length-for-age Z-scores were -3.46 (0.84) and -3.99 (1.16), respectively. Half of the children had Pseudo-Bartter syndrome, and 42.9% had breathing difficulties. Twelve children (85.7%) required hospitalization, with a median (IQR) length of stay of 17.0 (11.5-26.5) days.
DISCUSSION: newborn screening had some faults, from incorrect collections to inefficient active search. Early identification of these children in which screening was unsatisfactory is essential, emphasizing the importance and efforts to not miss them. In the case of a failed test, healthcare professionals must be prepared to recognize the main symptoms and signs of the disease.
Keywords:
Cystic fibrosis, Newborn screening, Public health policy, Delayed diagnosis, Diagnostic errors
IntroduçãoA fibrose cística (FC) é um distúrbio genético hereditário, autossômico recessivo, causado pela presença de duas variantes patogênicas no
gene "
cystic fibrosis transmembrane conductance regulator" que codifica a proteína
CFTR. A doença é mais prevalente entre as populações caucasianas. A FC é crônica e progressiva, afetando vários órgãos e diminuindo a expectativa e a qualidade de vida.
1 O advento da Triagem neonatal (TN) da FC (TNFC) permitiu que o diagnóstico fosse feito numa fase mais precoce, contribuindo para melhorar os resultados a curto e longo prazo.
2Em 1979, Crossley
3 detectou altos níveis de tripsinogênio imunorreativo (IRT) em pacientes com FC, colaborando por maneira para o desenvolvimento da TNFC. Os níveis elevados de IRT são indicativos de lesão pancreática e sugerem, mas não confirmam, FC.
3Em todo o mundo, a dosagem da IRT é a primeira etapa dos vários protocolos da TNFC. Sua implementação tem contribuído para o diagnóstico precoce da FC, de preferência antes de dois meses de vida, quando poucos ou nenhuns sintomas da doença estão presentes.
1,4 No entanto, erros podem ocorrer durante os processos necessários para diagnosticar FC em um recém-nascido, seja devido a resultados falso-negativos ou erros de processamento durante o fluxo da TN.
A adoção de protocolos bem definidos para a operacionalização dos testes da TN visa prevenir erros técnicos e humanos e incorporar melhorias, aprimorando a sensibilidade e especificidade do teste. No entanto, ainda haverá uma certa porcentagem com resultados falso-negativos, intrínsecos ao método adotado para a TNFC.
1,4O objetivo da TN é diagnosticar doenças em estágios iniciais, de preferência quando o recém-nascido se encontra assintomático, tornando o tratamento mais eficaz.
1 Para tal, muitos profissionais de saúde devem colaborar para garantir que todas as fases funcionem corretamente. Os programas da TN são complexos e envolvem agências federais, estaduais e municipais, a um custo governamental relevante.
1O Programa Nacional de Triagem Neonatal (PNTN) abrange todos os 26 estados e o Distrito Federal do Brasil, e foi criado em 2001 pelo Sistema Unificado de Saúde Brasileiro (SUS).
1 Esse programa inicialmente consistia em três estágios distintos: rastreamento para fenilcetonúria e hipotireoidismo congênito, anemia falciforme e outras hemoglobinopatias, e fibrose cística. A TN para hiperplasia adrenal congênita e deficiência de biotinidase tornaram-se parte do PNTN em 2014.
1 A toxoplasmose congênita se juntou ao programa mais recentemente, resultando em sete doenças investigadas.
5Este estudo descreve dados clínicos de crianças com FC nascidas entre 2013 e 2019 que foram submetidas a TNFC e tiveram um diagnóstico atrasado (> 2 meses de vida) devido a um teste falso-negativo ou erros de processamento da TN. As crianças foram seguidas em um dos centros de referência para tratamento para FC (CRTFC) do estado. A avaliação consistiu em uma análise descritiva dos dados de registo desse CRTFC e do serviço de referência de triagem neonatal (SRTN).
O estudo faz parte de um grande projeto intitulado "
Screening neonatal for cystic fibrosis in the state of Bahia, Brazil: evaluation of the first five years", cujos dados já foram publicados.
6DescriçãoA TNFC foi implementada na Bahia em março de 2013, seguindo o protocolo proposto pelo Ministério da Saúde e pelo Grupo Brasileiro de Estudo da Fibrose Cística. O protocolo consiste em duas coletas de IRT distintas (IRT1/IRT2), com um ponto de corte de 70 ng/ml.
7 Amostras de IRT1 ou IRT2 de lactentes com mais de 30 dias de idade são consideradas inadequadas e pouco confiáveis, porque a concentração do IRT tende a ser menor após este período, aumentando o número de falso-negativo.
1,4,7 Crianças com duas amostras elevadas de IRT ou aquelas com mais de um mês de idade ou com apenas IRT1 (≥70 ng/ml) positivo devem ser encaminhadas a um CRTFC para realizar teste do suor (TS) e melhor investigação.
7Este estudo é uma série retrospectiva de casos que incluiu bebês nascidos entre 2013 e 2019, com FC, e que foram submetidos a TNFC no sistema de saúde pública, mas que foram diagnosticados tardiamente devido a um resultado de teste de triagem falso-negativo ou erros de processamento durante a TN. O grupo de crianças era do CRTFC de um hospital de ensino universitário.
A TNFC falso-negativa foi definida como: (1) IRT1 negativa (<70ng/ml), estado clínico compatível com FC, e TS positivo (≥60 mEq/L), ou (2) IRT1 positiva (≥70ng/ml), IRT2 negativa (<70 ng/mL), estado clínico compatível com FC e TS positivo (≥60 mEq/L).
Os erros de processamento da TNFC consistiram em: (1) IRT1 elevada (≥ 70 ng/ml), mas o indivíduo não conseguiu retornar para a coleta do IRT2 ou para o TS; ou (2) IRT1 mais IRT2 elevadas (≥70 ng/mL), no entanto, a pessoa não compareceu ao ou CRTFC para concluir investigação; ou (3) IRT1 ou IRT2 normais, porém realizados após 30 dias de vida (amostras inválidas), com posterior confirmação de diagnóstico de FC por sintomas clínicos compatíveis.
Todos os dados sobre o acompanhamento ambulatorial e hospitalar foram obtidos a partir dos registos eletrônicos de saúde destas crianças. A entrada de dados e análise foram realizadas usando o Microsoft Excel
® para Mac. Uma análise descritiva da população do estudo foi realizada utilizando medidas de tendência central (médias, medianas) e dispersão (desvio padrão e intervalo interquartil) para as variáveis quantitativas e medidas de frequência absoluta e relativa para as variáveis categóricas.
No momento da análise, 32 indivíduos com diagnóstico de FC tinham sido diagnosticados pela TNFC entre 2013 e 2019 e estavam sendo acompanhados no CRTFC. Quatorze dessas crianças foram incluídas neste estudo. Todos eles tinham atrasado o diagnóstico de FC, em oito casos (57,1%) devido a resultados falso-negativos e em seis casos (42,9%) devido a erros de processamento durante TN. Oito (57,1%) crianças eram do sexo masculino, enquanto 10 (71,4%) nasceram fora da capital do estado. O diagnóstico de FC foi confirmado pela elevação do cloreto de suor e/ou a identificação de duas variantes patogênicas do
gene CFTR com uma idade mediana ao diagnóstico (IIQ) de 5,3 (4,2–7,4), variando entre 2,3 e 8,2 meses.
No momento da admissão no CRTFC, 11 lactentes (78,6%) apresentavam comprometimento nutricional, sendo este o sintoma clínico mais comum. Cinco (45,5%) deles sofriam de desnutrição, que em 3 deles (60%) era grave. Sete (63,6%) tinham baixa estatura, e em um caso havia associação de desnutrição com o déficit estatural. O Z escore médio (DP) de peso para altura (P/A) para estes cinco lactentes com desnutrição foi de − 3,46 (± 0,84), e a média do Z score (DP) de altura para idade (A/I) para os sete casos com baixa estatura foi − 3,99 (± 1,16). Doze lactentes (85,7%) necessitaram de hospitalização para estabilizar seu estado clínico, com uma duração mediana (IIQ) de internamento de 17,0 (5-26,5) dias, variando de 5,0 a 55 dias. Sete recém-nascidos (50%) apresentaram insuficiência pancreática.
Além dos problemas nutricionais, os sintomas metabólicos, respiratórios e hepáticos estiveram presentes em sete (50,0%), seis (42,9%) e dois (13,4%) lactentes, respectivamente. Todas as crianças com síndrome de Pseudo-Bartter (alcalose metabólica hipoclorêmica) precisaram de hospitalização para estabilizar sua condição. Íleo meconial foi diagnosticado em uma criança que passou por cirurgia para tratar esta condição. Todos os dados clínicos e laboratoriais dos 14 doentes estão apresentados na Tabela 1.
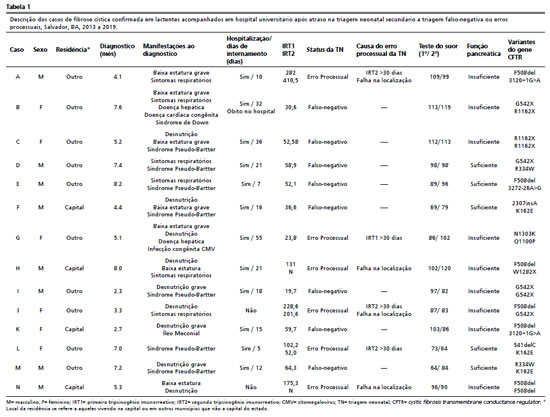
As causas de erros de processamento da TNFC incluíram quatro casos em que as amostras (IRT1 ou IRT2) foram coletadas após 30 dias de vida. Estes resultados foram normais em dois deles. No entanto, ambas as crianças deveriam ter sido encaminhadas para o CRTFC para realizar o TS. No primeiro caso, houve um resultado negativo para IRT1, e no segundo caso, o IRT1 foi elevado, mas o IRT2 foi negativo. Os outros dois casos também tinham amostras (IRT2) coletadas 30 dias após o nascimento, mas com resultados positivos. Nessas ocasiões, o esforço de busca ativa para estabelecer a comunicação com os pais, em tempo oportuno, provou ter sido falho. Além dos quatro casos acima mencionados, havia duas crianças que exibiam níveis elevados de IRT1, mas as diversas tentativas de convocação dos pais para levarem as crianças para o CRTF não foram exitosas.
Entre as oito crianças com resultados falso-negativos inclui-se um recém-nascido com íleo meconial, cuja amostra de sangue não foi enviada para análise até 28 dias após a coleta e outros dois lactentes com identificação de variantes de significado incerto no
gene CFTR.
8 As informações clínicas e laboratoriais de cada indivíduo, bem como as razões para o atraso no diagnóstico de FC, são detalhadas na Tabela 1.
Todas as crianças foram submetidas a pesquisa de variantes patogênicas e/ou sequenciamento completo do
gene CFTR, com identificação de 12 variantes diferentes. As frequências de alelos das variantes são descritas na Tabela 2.
DiscussãoEste estudo descreve casos em que a TNFC foi ineficaz, destacando os desafios experimentados e as principais consequências iniciais da FC não detectada. Devido à gravidade clínica precoce da doença, quase 90% dos lactentes foram hospitalizados ao diagnóstico. A duração média de permanência no hospital foi de 17 dias, e uma criança faleceu. A mediana da idade ao diagnóstico foi maior do que a aconselhada pelos protocolos da TNFC, girando em torno de cinco meses.
1Estes lactentes apresentaram sinais precoces de deficiência nutricional aguda (desnutrição) e crônica (nanismo). Apenas três (21,4%) tinham um estado nutricional adequado. Como apoiado por alguns estudos, a piora do estado nutricional de forma tão precoce está associada à gravidade clínica.
2 Parece haver uma clara associação entre a baixa estatura e a progressão desfavorável da doença, com esta relação tendendo a ser irreversível, desenvolvendo-se nos primeiros anos de vida, e associada à perda da função pulmonar.
9 Portanto, o estado nutricional parece ser um indicador precoce de FC e deve ser considerado como um importante sinal de alerta para profissionais de saúde. Neste estudo, o grave comprometimento nutricional foi comum ao diagnóstico da FC, contribuindo para piores prognósticos a curto e longo prazo.
Outros sintomas clínicos comuns nestas crianças incluíam problemas hidroeletrolíticos, particularmente a síndrome de Pseudo-Bartter. Esta síndrome é capaz de causar grave morbidade, incorrendo em hospitalização, como foi o caso de todos os lactentes desse estudo.
10,11 Em um estudo italiano com uma coorte retrospectiva,
10 observou-se 18 casos de TNFC falso-negativos, com sete ocorrências (38,8%) da síndrome de Pseudo-Bartter. Em outro estudo, em 1992, com metodologia equivalente, este transtorno foi detectado em menos do que 13,0% dos casos.
11 Na verdade, esta manifestação parece ser influenciada pelas condições climáticas da região da população, bem como pelas variantes alélicas presentes.
11 O estado da Bahia tem um clima tropical; portanto, as temperaturas são altas quase todo o ano, o que pode ter contribuído para a maior prevalência da síndrome de Pseudo-Bartter relatada aqui.
O íleo meconial é uma condição associada a resultados negativos na TNFC e é tipicamente o primeiro sinal de FC, exigindo, desse modo, medidas eficazes que aprimorem os cuidados aos recém-nascidos. Ainda que a TNFC seja negativa, a realização do TS e/ ou pesquisa de variantes ou sequenciamento do
geneCFTR deverá ser realizada nessa condição.
1,7 De acordo com dados disponíveis da Europa e América do Norte, observou-se que o íleo meconial afeta cerca de 20% dos indivíduos na população com FC.
12 Em um estudo anterior realizado no Brasil, em 2001, a prevalência estimada de íleo meconial foi de cerca de 7,0%.
13 Entretanto, a taxa de incidência no CRTFC, onde foi conduzida essa pesquisa, se mostrou inferior, em torno de 3,0%. Claramente são necessárias investigações adicionais para determinar as causas subjacentes destas disparidades. Podem coexistir questões relacionadas às subnotificações e às diferenças regionais na apresentação clínica deste sintoma que também podem ser atribuídas à uma ampla gama de variantes genéticas observadas nessa população.
Embora a dosagem do IRT constitua um instrumento relevante para a TNFC, existem alguns problemas com este método.
4 A percentagem de testes falso-negativos considerada aceitável varia de 5 a 15%, com o protocolo IRT/IRT apresentando a pior sensibilidade.
1,4 Apesar destas dificuldades, os modelos de TNFC implementados em todo o mundo usam a dosagem do IRT como a primeira etapa do processo.
1,4A estratégia IRT/IRT depende da disponibilidade dos recursos de saúde necessários para obter uma segunda amostra para IRT2 dentro de um período de tempo adequado.
4 Em um estudo recente realizado na Turquia, em 2021, apenas cerca de 70% dos recém-nascidos submetidos a TNFC passaram por uma segunda dosagem do IRT, antes do diagnóstico ser confirmado.
14 Estudo maior, deste grupo de pesquisa, utilizando dados dos primeiros cinco anos da TNFC no Estado da Bahia revelou que apenas 76,4% dos bebês que testaram positivo para IRT1 foram retestados.
6 Estes dados demonstram claramente as dificuldades envolvidas na obtenção de uma segunda amostra do IRT2, particularmente em um estado tão grande como a Bahia.
Entre os seis casos com erros de processamento durante a TN, dois (42,9%) tiveram as amostras para IRT1 e IRT2 coletadas após 30 dias de vida, com resultados considerados negativos pelo SRTN. IRT1 e/ou IRT2 foram positivos nos quatro casos restantes. Nestes casos, os erros ocorreram durante a fase de busca ativa, com a incapacidade do SRTN de localizar estas crianças para completar a investigação diagnóstica. De acordo com um estudo realizado nos Estados Unidos em 2022,
15 a dificuldade de comunicação entre o SRTN, as unidades de saúde primárias e a família da criança é uma barreira significativa para o diagnóstico precoce da doença investigada, reconhecendo a necessidade de educação contínua dos profissionais de saúde e do público em geral em benefício da TN. O estudo do nosso grupo, já citado anteriormente, citou problemas comparáveis e defendeu estratégias para superar esses obstáculos.
6Esta série de casos observou que o tempo mediano necessário para analisar as amostras do IRT1 foi de 8,5 dias, com 7/14 amostras (50%) coletadas após 10 dias de vida, das quais uma foi coletada após 30 dias de idade. Fatores ambientais como as altas temperaturas do estado da Bahia e o tempo entre a coleta da amostra e chegada ao SRTN podem ter contribuído para os casos falsos-negativos. O estudo realizado por Therrel
et al.,
4 em 2012, mostrou uma importante redução nos valores do IRT em amostras coletadas no papel filtro e armazenadas durante uma semana em alta temperatura e umidade. Sabe-se que os atrasos na análise das amostras afetam a qualidade e, consequentemente, os resultados dos testes.
4 Isto enfatiza a importância de um fluxo adequado para melhorar a eficácia de um programa de TN.
O grau de heterogeneidade alélica na população examinada pode afetar a sensibilidade do teste IRT,
1,4 particularmente quando existem variantes com baixa frequência populacional, como observado nesta população estudada (12 diferentes variantes do
gene CFTR entre os 14 indivíduos avaliados). A variante K162E é classificada como de significado incerto, sendo observada em heterozigose em três lactentes, todos diagnosticados com síndrome de Pseudo-Bartter.
8 Nestes casos, a doença teve uma apresentação mais leve em duas das crianças; no entanto, a terceira criança, teve
Pseudomonas aeruginosa em múltiplas ocasiões, além de ter desenvolvido insuficiência pancreática.
As limitações deste estudo incluem o seu desenho e o pequeno número de participantes. No entanto, o estudo foi capaz de identificar questões logísticas que prejudicam o sucesso do programa da TNFC, tais como questões com a coleta de amostras e a localização de crianças com IRT elevado.
Este trabalho destaca a importância de melhorar os procedimentos da TNFC, objetivando reduzir a incidência de falso-negativos e a perda de casos pela busca ativa. As informações de contato dos genitores, como número de telefone e endereço, devem ser registradas cuidadosamente, pois são necessárias para a futura localização dessa criança, reduzindo as perdas. Os profissionais de saúde devem ser continuamente treinados e lembrados da importância da TN e de sua adequada execução. Reconhecer os casos em que há falhas e, portanto, atraso no diagnóstico da FC é um passo relevante para a compreensão e melhoria de todo o sistema de saúde e das políticas públicas envolvidas com o programa da TNFC. É essencial que os profissionais de saúde sejam capazes de diagnosticar as manifestações clínicas mais comuns em crianças com FC, mesmo que os resultados da TN sejam negativos, evitando consequências a longo prazo da doença.
Com base neste estudo, a prevenção do diagnóstico retardado da FC não foi satisfatoriamente alcançada e ainda existem aspectos da triagem que precisam ser melhorados. A TNFC é um importante Programa de Saúde Pública que deve ser avaliado continuamente.
Referências1. Ministério da Saúde (BR). Secretaria de Atenção a Saúde. Departamento de Atenção Especializada e Temática. Triagem Neonatal Biológica. Manual Técnico. 1ª ed. Brasília (DF): Ministério da Saúde; 2016. [acesso em 2023 Mai 6]. Disponível em:
https://bvsms.saude.gov.br/bvs/publicacoes/triagem_neonatal_biologica_manual_tecnico.pdf2. Tridello G, Castellani C, Meneghelli I, Tamanini A, Assael BM. Early diagnosis from newborn screening maximises survival in severe cystic fibrosis. ERJ Open Res. 2018 Apr; 4 (2): 00109-2017.
3. Crossley JR, Smith PA, Edgar BW, Gluckman PD, Elliott RB. Neonatal screening for cystic fibrosis, using immunoreactive trypsin assay in dried blood spots. Clin Chim Acta. 1981 Jun; 113 (2): 111-21.
4. Therrell BL, Hannon WH, Hoffman G, Ojodu J, Farrell PM. Immunoreactive trypsinogen (IRT) as a biomarker for cystic fibrosis: challenges in newborn dried blood spot screening. Mol Genet Metab. 2012 May; 106 (1): 1-6.
5. Ministério da Saúde (BR). Portaria GM/MS N
o 1.369, de 6 de Junho de 2022. Altera e inclui procedimento relacionado a Triagem Neonatal na Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materiais Especiais (OPM) do Sistema Único de Saúde (SUS) e estabelece recurso do Bloco de Manutenção das Ações e Serviços Públicos de Saúde - Grupo de Atenção Especializada, a ser incorporado ao limite financeiro de Média e Alta Complexidade (MAC), de Estados. Brasília (DF): Ministério da Saúde; 2022. [
Internet]. [acesso em 2023 Mai 6]. Disponível em:
https://bvsms.saude.gov.br/bvs/saudelegis/gm/2022/prt1369_08_06_2022.html6. Godoy C, Paixão DC, Boa-Sorte NCA, Amorim T, Silva Filho LVRF, Souza EL. Five-year performance analysis of a cystic fibrosis newborn screening program in northeastern Brazil. J Pediat (Rio J). 2023; 99 (1): 23-30.
7. Athanazio RA, Silva Filho LVRF, Vergara AA, Ribeiro AF, Riedi CA, Procianoy EFA,
et al. Brazilian guidelines for the diagnosis and treatment of cystic fibrosis. J Bras Pneumol. 2017; 43 (3): 219-45.
8. Souza EL, Mota LR, Lima RLLF, Bittencourt PH, Guedes VMCR, Salinas D. K162E - A rare and uncategorized CFTR variant causing cystic fibrosis. J Cyst Fibros. 2021 May; 20 (3): 489-91.
9. Marks MP, Heltshe SL, Baines A, Ramsey BW, Hoffman LR, Stalvey MS. Most Short Children with Cystic Fibrosis Do Not Catch Up by Adulthood. Nutrients. 2021 Dec; 13 (12): 4414.
10. Taccetti G, Botti M, Terlizzi V, Cavicchi MC, Neri AS, Galici V,
et al. Clinical and genotypical features of false-negative patients in 26 years of cystic fibrosis neonatal screening in Tuscany, Italy. Diagnostics (Basel). 2020 Jul; 10 (7): 446.
11. Davis SL, Gunn TR, Tonkin SL, Hadden W. Genetic and clinical features of false-negative infants in a neonatal screening programme for cystic fibrosis. Acta Paediatr. 2002; 91 (1): 82-7.
12. Sathe M, Houwen R. Meconium ileus in Cystic Fibrosis. J Cyst Fibros. 2017 Nov; 16 (Supl. 2): S32-9.
13. Oliveira MCLA, Reis FJC, Monteiro APAF, Penna FJ. Effect of meconium ileus on the clinical prognosis of patients with cystic fibrosis. Braz J Med Biol Res. 2002; 35 (1): 31-8.
14. Gokdemir Y, Eyuboglu TS, Emiralioglu N, Er B, Sen V, Pekcan S,
et al. Geographical barriers to timely diagnosis of cystic fibrosis and anxiety level of parents during newborn screening in Turkey. Pediatric Pulmonol. 2021 Oct; 56 (10): 3223-31.
15. Sontag MK, Miller JI, McKasson S, Gaviglio A, Martiniano SL, West R,
et al. Newborn Screening for Cystic Fibrosis: A Qualitative Study of Successes and Challenges from Universal Screening in the United States. Int J Neonatal Screen. 2022 Jun; 8 (3): 38.
Agradecimentos: Agradecemos à Fundação de Apoio à Pesquisa do Estado da Bahia (FAPESB) e ao Grupo Brasileiro de Estudos sobre Fibrose Cística (GBEFC).
Contribuição dos autores: Godoy C: concepção, análise, investigação, metodologia, supervisão, validação, interpretação dos dados e redação do rascunho e revisão do artigo; Radel I: curadoria de dados, análise, investigação, validação, visualização e redação do rascunho original do artigo; Mota LR: investigação, validação, visualização e redação e revisão do artigo; Santos MA: concepção, análise, validação e visualização do artigo; Terse-Ramos R: concepção, planejamento metodológico, validação, visualização e redação e revisão do artigo; Souza EL: concepção, análise, investigação, recursos, supervisão, interpretação dos dados e redação do rascunho e revisão do artigo.
Todos os autores aprovaram a versão final do artigo e declaram não haver conflito de interesses.
Recebido em 24 de Julho de 2023
Versão final apresentada em 19 de Novembro de 2023
Aprovado em 23 de Novembro de 2023
Editor Associado: Karla Bomfim
 ; Igor Radel2
; Igor Radel2 ; Laís Ribeiro Mota3
; Laís Ribeiro Mota3 ; Marília Augusta Santos4
; Marília Augusta Santos4 ; Regina Terse5
; Regina Terse5 ; Edna Lúcia Souza6
; Edna Lúcia Souza6