RESUMO
OBJETIVOS: investigar a relação entre uso de insulina, estado nutricional pré-gestacional e ganho de peso materno durante a gestação de mulheres com diabetes mellitus gestacional.
MÉTODOS: estudo transversal retrospectivo (2017–2022) com dados de mulheres atendidas em um hospital universitário do sudeste do Brasil. A adequação do ganho de peso foi avaliada segundo curvas específicas para gestantes brasileiras. Foram analisados estado nutricional pré-gestacional, idade, estatura, raça, escolaridade, situação conjugal, localidade, paridade, número de gestações e abortos, glicemia de jejum e distúrbios hipertensivos. O uso de insulina foi considerado desfecho em modelo de regressão logística múltipla, adotando-se como referência as categorias menos associadas ao diabetes mellitus gestacional.
RESULTADOS: entre 353 participantes, 48,7% eram obesas e 47,4% utilizaram insulina. Obesas apresentaram maiores chances de uso de insulina (OR= 2,26; IC95%= 1,16–4,41; p=0,003). Quanto ao ganho de peso, eutróficas com ganho acima do adequado tiveram maior chance de utilizar insulina (OR= 3,22; IC95%= 1,15–9,05; p=0,024). Entre as que tiveram ganho adequado ou abaixo do adequado, obesas mostraram maiores chances de necessitar insulina (OR= 4,33; IC95%= 1,76–10,6; p=0,001).
CONCLUSÃO: os achados reforçam a necessidade de diretrizes específicas de ganho de peso para mulheres com diabetes mellitus gestacional, considerando diferenças de estado nutricional e padrão de ganho durante a gestação.
Palavras-chave:
Ganho de peso materno, Diabetes melittus gestacional, Insulinoterapia
ABSTRACT
OBJECTIVES: to investigate the relation between insulin use, pregestational nutritional status, and maternal weight gain during pregnancy among women with gestational diabetes mellitus.
METHODS: a retrospective cross-sectional study (2017-2022) was conducted with data from women followed at a University hospital in the Southeast of Brazil. Maternal weight gain adequacy was assessed according to new curves proposed for Brazilian pregnant women. Pregestational nutritional status, age, height, race, schooling, marital status, residence, parity, number of pregnancies and abortions, fasting glucose, and hypertensive disorders were analyzed. The use of insulin was considered the outcome in a multiple logistic regression model, using as reference, the categories least associated with gestational diabetes mellitus.
RESULTS: among the 353 participants, 48.7% were obese and 47.4% required insulin. Obese women were more likely to use insulin (OR= 2.26; 95%CI= 1.16-4.41; p=0.003). Regarding to weight gain, eutrophic women with above-adequate gain had greater odds of insulin use (OR= 3.22; 95%CI= 1.15-9.05; p=0.024). Conversely, among those with adequate or below-adequate gain, obese women showed higher chances of needing insulin (OR= 4.33; 95%CI= 1.76-10.6; p=0.001).
CONCLUSION: the findings reinforce the necessity for specific guidelines on gestational weight gain for women with gestational diabetes mellitus, considering differences in both nutritional status and weight gain patterns throughout pregnancy.
Keywords:
Maternal weight gain, Gestational diabetes mellitus, Insulin therapy
IntroduçãoMundialmente o Diabetes Mellitus Gestacional (DMG) representa de 75 a 90% dos casos de diabetes entre gestantes
1 contribuindo para epidemia de diabetes mellitus 2 (DM). Cerca de metade das mulheres com DMG no mundo poderão desenvolver DM até dez anos após a gestação e/ou geram filhos com mais probabilidade de desenvolverem diabetes e obesidade no futuro.
2 Entre 2014 e 2019 o DMG respondeu por 15,32% das mortes maternas no Brasil, tornando-se o terceiro maior fator responsável.
3 Apesar de controversos e escassos os dados brasileiros sobre prevalência de DMG, metanálise identificou por critérios diagnósticos atuais 18% entre adultas
4 sendo que 10% deste percentual é atribuído a obesidade.
5A obesidade por sua vez atinge um terço das mulheres em idade reprodutiva,
6 tendo seu número dobrado entre 2003 e 2019 em mulheres de 20 anos, passando de 14,5% para 30,2%.
7 Mulheres com obesidade tem risco de morte aumentado no desenvolvimento de uma gestação
8 e o Índice de Massa Corporal (IMC) é o principal parâmetro associado ao DMG com vários estudos identificando ligação entre sobrepeso e obesidade prévias, ou ganho de peso gestacional inadequado com seu desenvolvimento.
9 Mesmo assim, as recomendações mais utilizadas de ganho de peso são propostas até para gestantes com sobrepeso e obesidade
10 inclusive em novos estudos, sendo que todos foram conduzidos com mulheres saudáveis e sem doenças ou distúrbios que pudessem comprometer o peso materno.
11,12 Gestantes com diabetes seguem a mesma recomendação de ganho de peso que as demais
13 com poucos estudos avaliando consequências específicas e tratamentos opcionais. Adicionalmente, essas mulheres também precisam monitorar sua glicemia durante todo período gestacional, com metas estabelecidas, para que tenham melhores desfechos.
14O primeiro tratamento para gestantes com DMG é a terapia nutricional e o incentivo a prática de exercícios físicos para o controle de peso e consequentemente melhor controle glicêmico. A terapia farmacológica com insulina é iniciada apenas quando necessário, para as gestantes que não atingirem a meta glicêmica apenas com dieta e exercícios.
15 Subentende-se então, que gestantes que não controlam seu ganho ponderal durante a gestação e/ou que iniciam a gestação com sobrepeso e obesidade também estão sujeitas a não terem um bom controle glicêmico fazendo-se necessária então a adição de insulina em seu tratamento com maior frequência que as demais. Neste sentido, o presente estudo teve como objetivo investigar a relação entre uso de insulina (UI), estado nutricional pré-gestacional (ENP) e ganho de peso (GP) materno durante a gestação de mulheres com diabetes mellitus gestacional (DMG).
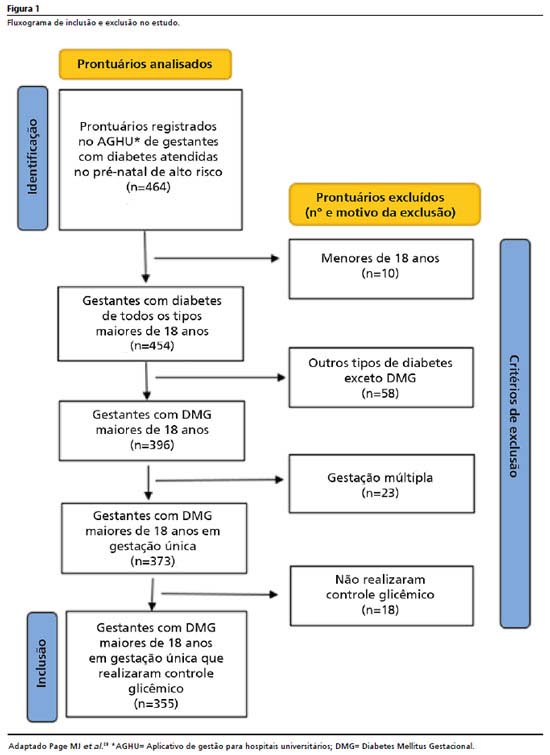
MétodosEstudo transversal retrospectivo com uso de dados secundários coletados em prontuários eletrônicos de gestantes com DMG atendidas nos anos de 2017 a 2022, em um serviço pré-natal de alto risco de um hospital universitário do sudeste brasileiro. Foram analisados 464 prontuários, dentre os quais foram incluídas 355 mulheres de 18 anos ou mais com DMG em gestação de feto único e que continham em seus respectivos prontuários todos os dados correlatos necessários ao estudo. Os critérios de exclusão foram idade menor que 18 anos, outros tipos de diabetes, gestação múltipla e não realização de controle glicêmico durante o pré-natal. Após aplicação dos critérios de exclusão, 109 mulheres foram excluídas do estudo conforme descrito no fluxograma (Figura 1).
As variáveis estudadas incluíram as seguintes caraterísticas sociodemográficas: idade (anos), situação conjugal (solteira ou viúva ou desquitada e casada ou união estável), escolaridade (sem ensino médio, com ensino médio, com ensino superior), cor da pele (preta, parda, branca)
9 e localidade (interior do estado, região metropolitana, capital).
Dentre as características antropométricas foram coletadas estatura (até 160cm, acima de 160 cm),
9 estado nutricional pré-gestacional (baixo peso, eutrofia, sobrepeso e obesidade) e ganho de peso gestacional, classificado de acordo com os critérios das novas curvas para gestantes brasileiras
12 e dividido em duas categorias: as que se encontravam dentro ou abaixo dos percentis de adequação e as que se encontravam acima dos percentis de adequação.
As características clínicas e obstétricas incluíram: semana gestacional, paridade (nulíparas, a partir de uma gestação), número de gestações (primigestas, a partir de duas gestações) e abortos (sim, não), glicemias de jejum (acima ou abaixo de 92 mg/dl), presença ou história de distúrbios hipertensivos (sim, não) e, como variável desfecho de interesse, a utilização de insulina como terapia adjuvante ao tratamento do DMG.
Os dados coletados foram digitados e armazenados em um banco de dados elaborado no programa da Microsoft Office Excel 2016. Para condução das análises estatísticas, os dados foram transportados ao programa
Social Package Statistical Science (SPSS) para Windows versão 22.0. A caracterização da amostra foi realizada por meio da distribuição de frequências e estimativa de medidas de tendência central e de dispersão.
As associações entre variáveis categóricas, foram verificadas através dos testes de Pearson, qui quadrado e/ou exato de Fisher, em que foram adotados nível de significância de 5%. Modelos de regressão logística multivariada foram testados para avaliar o efeito das variáveis independentes no UI. Foram calculados
odds ratios (OR) brutos e ajustados pelas demais variáveis, com intervalos de confiança de 95%.
Nos modelos de regressão multivariada, cada variável independente testada, teve como categoria de referência, aquela que teoricamente menos se associaria ao UI.
9 Para a construção do modelo linear múltiplo utilizou-se, como critérios para a inclusão das variáveis, o valor
p≤0,20, obtido na análise bivariada. No modelo final, por sua vez, utilizou-se o método
backward, sendo que aquelas variáveis com menor significância (maior valor
p) foram retiradas uma a uma do modelo. O procedimento foi repetido até que todas as variáveis presentes no modelo possuíam significância estatística (
p<0,05).
O presente estudo seguiu as normas da Resolução CNS 466/12 do MS (BRASIL, 2012), sendo aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal do Espírito Santo de pesquisa sob o nº CAAE: 66626222.0.0000.5060 em 13/12/2022 e pela Rede de Pesquisa da rede EBSERH sob o nº 23525.017280/2022-95 SEI Nº 25914497 em 28/11/2022.
ResultadosA Tabela 1 apresenta características da amostra de 355 gestantes com DMG com idade média de 31 ± 6,4 anos, peso pré-gestacional médio de 79,8 ± 18,7 kg e GP em torno 7,91 ± 7,06 kg ao final da gestação de 36 ±4 semanas. Também estão descritas as associações entre o UI e as variáveis de interesse onde observa-se associação estatística significativa entre estado nutricional pré-gestacional (
p=0,003), idade (
p=0,014), número de gestações (
p=0,001), paridade (
p=0,004) e localidade (
p=0,046). A maior proporção de UI foi entre as mulheres com obesidade e/ou idade de 35 anos ou mais e/ou pelo menos um parto e/ou a partir de duas gestações e/ou moradoras da capital (
p<0,05). Não foram encontradas diferenças significativas entre o UI e as demais variáveis do estudo. Também são apresentados os resultados da análise multivariada tendo a variável UI como desfecho (Tabela 1). Observou-se que mulheres obesas (OR= 2,26; IC95%= 1,16-4,41;
p=0,003) apresentam maiores chances de utilizar insulina para controle do DMG em relação às demais. Por outro lado, morar na região metropolitana de Vitória demonstrou ser fator de proteção em relação ao UI no controle do DMG (OR=0,61; IC95%= 0,37-0,99;
p=0,046). No entanto, este último achado pode representar um fator de confusão a ser discutido adiante.
A Tabela 2 apresenta a regressão logística entre o ganho de peso e o UI na gestação por categoria do ENP. Verificou-se que houve diferença estatística significativa para as eutróficas (
p=0,024), sendo observado no grupo que ganhou peso acima do adequado 3,22 mais chances de usar insulina quando comparado às que ganharam peso adequado ou abaixo do adequado.
Também é possível notar predominância significativa do grupo sem UI entre as mulheres classificadas com eutrofia ou sobrepeso (
p=0,186) que ganharam peso adequado ou abaixo do adequado com 78,4 e 72 %, respectivamente. Uma redução da diferença inversamente proporcional ao ENP é notada quando se observa entre as obesas os percentuais de uso e não uso de insulina muito próximos com 45,6 e 43 %, em que a significância estatística foi irrelevante (
p=0,617) para a variável GP.
Para o baixo peso, embora em número substancialmente menor, o inverso ocorre quando a predominância significativa do UI está entre as que ficaram com GP adequado ou abaixo do adequado (75%). Neste mesmo grupo o oposto ocorreu entre as que tiveram GP acima do adequado com o mesmo percentual para o não UI (75%).
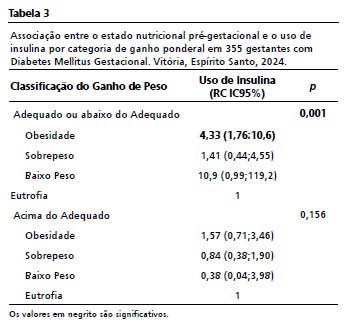
Quando a relação entre o estado nutricional pré-gestacional e o UI é realizada por cada uma das categorias de GP (Tabela 3), observa-se significância estatística para o grupo de GP adequado ou abaixo do adequado (
p=0,001). Somente as mulheres obesas do estudo permaneceram dentro do intervalo de confiança com chances significativamente maiores de UI (OR= 4,33;IC95%= 1,76-10,6;
p=0,001).
Quando analisado o grupo com GP acima do adequado o nível de significância é reduzido (
p=0,156) e a associação negativa ao desfecho UI se mantém em todas as categorias de ENP. De maneira interessante o mesmo acontece para as obesas, que antes com GP abaixo ou adequado do adequado apresentavam diferença significativa, agora com GP acima do adequado se assemelham às demais (OR=1,57; IC95%= 0,71-3,46;
p=0,156).
DiscussãoEntre 70 a 85% dos casos de DMG podem ser tratados com exercícios e dieta adequada, sendo que apenas 15 a 30% das pacientes necessitarão de medicamentos.
16 Apesar disso, em nosso estudo, quase metade da amostra (47,04%) necessitou de terapia adjuvante com insulina, mesmo num cenário onde essas mulheres receberam atendimento multidisciplinar com dietoterapia. Este resultado remete a realidade de que também quase metade da amostra constituiu-se de mulheres obesas (48,7%). Somados aos 28,7% de sobrepeso, o resultado foi uma amostra constituída em quase 80% de mulheres que gestaram acima do peso.
Este dado não difere da literatura.
17 Brasileiras eutróficas que realizam pré-natal no sistema de saúde público são a minoria,
18 confirmando o observado na amostra do presente estudo, com apenas 20,3% de eutróficas. Essa primeira constatação nos reportou ao aumento global dos índices de obesidade que também resultou em um crescimento no número de mulheres obesas que engravidam e desenvolvem DMG de duas a cinco vezes mais do que mulheres com peso adequado.
19,20,21No Brasil, entre 2003 e 2019, a proporção de mulheres obesas na população com cerca de 20 anos de idade quase dobrou, com o aumento de peso proporcional à idade. Entre as faixas reprodutivas foram apurados 41,4 % de sobrepeso e 13,5% de obesidade dos 18 aos 24 anos. Esse índice salta para 57% e 27,9% respectivamente entre 25 e 39 anos,
7 faixa etária na qual se encontravam 83,66% das mulheres no presente estudo. A idade neste estudo foi significativamente relacionada à UI da mesma forma que o ENP, a paridade e o número de gestações mais elevados. Vale aqui atentar para a inter-relação entre essas variáveis quando mulheres mais velhas tendem a ter mais filhos e índice de massa corporal mais elevado.
22O IMC corporal é mesmo considerado o principal indicador para desenvolvimento da resistência insulínica (RI) e do DMG,
9,23 confirmado por nosso estudo, em que o ENP apareceu aqui significativamente relacionado ao UI, com as obesas usando cerca de duas vezes mais insulina comparado às eutróficas. O GP quando analisado por ENP só teve destacada a significância estatística entre eutróficas, sendo reduzida a significância à medida que se aumentava o IMC seguindo assim uma escala inversamente proporcional, ou seja, quanto maior o índice de massa corporal, menor a associação do GP ao UI.
Entre GP por ENP e UI, a relação apareceu somente para as eutróficas, que por sua vez usaram consideravelmente mais insulina quando ganharam peso acima do adequado.
Há tempo a literatura mostra o papel da RI como resposta à manutenção do peso.
24 Na tentativa de manter o peso ela aumentará a lipólise com consequente liberação de ácidos graxos e glicerol na corrente sanguínea aumentando a glicemia.
24,25 Assim é possível constatar que o aumento sérico desses componentes no peso excessivo fatalmente poderá incorrer na maior necessidade de UI.
De forma interessante, quando o ENP foi analisado por cada um dos dois grupos de GP as obesas apareceram com 4,22 vezes mais chances de UI quando ganharam peso adequado ou abaixo da recomendação em relação às eutróficas e a mesma associação, perdeu significância estatística entre as mulheres que ganharam peso acima do adequado. Mais uma vez o achado do presente estudo soma-se ao descrito em literatura. Em um ensaio clínico randomizado, Harreiter
et al.,
25 analisaram o impacto da alimentação saudável e atividade física no metabolismo lipídico materno de 436 gestantes obesas visando GP gestacional restrito. Eles verificaram que no grupo em que o GP foi menor, concentrações substancialmente maiores de ácidos graxos livres e corpos cetônicos foram encontrados no sangue, aumentando a glicemia principalmente em jejum.
25 Assim subentende-se que gestantes obesas que ganhem peso insuficiente ou que perdem peso, terão sua glicemia aumentada e fatalmente mais necessidade de UI. O que pode ter acontecido na presente investigação.
O problema é que já foi descrito em outros estudos que 50% das gestantes obesas perdem peso na mesma proporção em que ganham peso excessivo.
18 Exatamente como observado no presente estudo em que vimos entre as obesas percentuais bem próximos de GP adequado ou abaixo do adequado (54,4%) e acima do adequado (58,2%). Perda de peso entre gestantes com obesidade também foi observada e problematizada no estudo com as brasileiras que serviu de base para elaboração das novas curvas, lembrando que o mesmo foi conduzido com mulheres sem doenças prévias infecciosas ou crônicas, exceto obesidade, inclusive diabetes e doenças hipertensivas, e com bons resultados na gestação. O autor reporta a perda de peso entre gestantes com obesidade como uma
"observação preocupante frente a perda de peso não recomendada na gestação".
12Ganho de peso inadequado foi visto também em 64,2% de 545 mulheres com DMG principalmente entre obesas e sobrepeso, o UI foi necessário em 41% e 34,8% tiveram complicações gestacionais principalmente distúrbios hipertensivos.
17Recomendações de GP na gestação são amplamente questionadas e fundamentam revisões sistemáticas principalmente para obesas.
6,12,20,26 Bogaerts
et al.,
26 ao analisarem 18.053 gestantes obesas observaram ganho insuficiente, inclusive perda ponderal, com redução de hipertensão gestacional e cesárea de emergência.
26 Kapadia
et al.,
6 em sua revisão sobre as recomendações de ganho de peso entre gestantes obesas sugerem que o GP abaixo das recomendações mais utilizadas mundialmente pode até ser eventualmente recomendado de forma singular mediante análise individualizada.
6Tais resultados confirmam a hipótese de que o ENP pode influenciar UI, já o GP influenciará em diferentes nuances, a depender do ENP. Parece que o peso excessivo é o principal responsável, independentemente de ser prévio ou adquirido na gestação, quando mulheres com sobrepeso e obesidade usaram mais insulina somente pelo fato de já terem iniciado a gestação acima do peso e eutróficas só após excederem o peso na gestação.
De fato, mulheres grávidas obesas, sem diabetes ou as com diabetes gestacional sem obesidade demonstram RI de forma semelhante e que se diferenciam das mulheres que têm uma gestação sem essas duas condições.
27 Essas descobertas destacam a importância de mais estudos que possam fundamentar abordagens personalizadas no manejo da DMG, incluindo o desenvolvimento de recomendações de GP diferenciadas para mulheres com essa condição, principalmente entre as que apresentam obesidade prévia.
Recomendações específicas podem ajudar a otimizar o atendimento pré-natal melhorando resultados maternos e neonatais no pós-parto e ao longo da vida, uma vez que o DMG já é reconhecido como preditor de diabetes mellitus, doenças cardiovasculares, e obesidade na prole inclusive na vida adulta.
1,2O período a que se refere o presente estudo (2017-2022) compreende um cenário de transição para o tratamento de DMG Brasil, com definição de fluxos de diagnóstico e tratamento.
28 As informações de diagnóstico e tratamento divergiam entre profissionais e serviços. Sendo assim, não foi possível quantificar as alterações do controle glicêmico devido a não padronização de tais informações descritas em prontuário. Optou-se então pelo desfecho UI como uma variável binária mais viável para se quantificar e/ou qualificar.
O estudo apresenta limitações, como o delineamento transversal, que não permite avaliar relações de causalidade. Ainda assim, oferece subsídios relevantes para a compreensão do manejo do diabetes gestacional em diferentes contextos do sistema de saúde brasileiro. A variável localidade pode ter atuado como fator de confusão, uma vez que mulheres residentes em regiões periféricas podem ter recebido menos insulina não apenas por menor necessidade clínica, mas por barreiras de acesso, diagnóstico tardio ou insuficiência de insumos e infraestrutura.
Além disso, não há consenso quanto ao ponto de corte para início da insulinoterapia. Enquanto o Ministério da Saúde recomenda a adoção de 30% de alterações glicêmicas,
29 padrões internacionais indicam limiares mais baixos, o que reforça a heterogeneidade nas condutas e a necessidade de diretrizes nacionais mais precisas e atualizadas.
Este estudo mostrou que tanto o estado nutricional pré-gestacional quanto o padrão de ganho de peso durante a gestação influenciam na necessidade de insulinização. Conclui-se que o tratamento do diabetes gestacional permanece em transição, com carência de dados epidemiológicos no Brasil. Estudos longitudinais são necessários para subsidiar protocolos mais assertivos, especialmente em serviços de alto risco, assim como fundamentar melhores estratégias para gerenciamento de medicamentos, profissionais, projetos de promoção e prevenção no cuidado com o DMG.
Esses achados reforçam a importância de diretrizes específicas de ganho de peso para mulheres com diabetes gestacional, de modo a apoiar condutas clínicas mais adequadas e reduzir riscos maternos e fetais.
Referências1. Wahabi HA, Fayed A, Esmaeil S, Elmorshedy H, Titi MA, Amer YS,
et al. Systematic review and meta-analysis of the effectiveness of pre-pregnancy care for women with diabetes for improving maternal and perinatal outcomes. PLOS ONE. 2020 Ago; 15 (8): e0237571.
2. Mirghani Dirar A, Doupis J. Gestational diabetes from A to Z. World J Diabetes. 2017 Dez; 8 (12): 489-511.
3. Perivolaris EC, Cavalcante SKDS, Silva MNCD, Teixeira JPS, Silva VF, Dinelly ÉMP. Complicações na gravidez e diabetes mellitus na gestação: dados de morbidade e mortalidade no Brasil. Rev Soc Dev. 2021 Ago; 10 (11): e142101119335.
4. Iser BPM, Stein C, Alves LF, Carvalho MLS, Espinoza SAR, Schmidt MI. A portrait of gestational diabetes mellitus in Brazil: A systematic review and meta-analysis. Arch Endocrinol Metab. 2023 Out; 67 (6): e220521.
5. Junqueira JMO, Nascimento S, Marques SR, Fontes JF. Diabetes mellitus gestacional e suas complicações. Braz J Dev. 2021 Dez; 7 (12): 116574-89.
6. Kapadia MZ, Park CK, Beyene J, Giglia L, Maxwell C, McDonald SD. Weight Loss Instead of Weight Gain within the Guidelines in Obese Women during Pregnancy: A Systematic Review and Meta-Analyses of Maternal and Infant Outcomes. PLoS One. 2015; 10 (7): e0132650.
7. Agência Brasil 2020. IBGE: obesidade mais do que dobra na população com mais de 20 anos. [
Internet]. [acesso em 2024 Mar 13]. Disponível em:
https://agenciabrasil.ebc.com.br/saude/noticia/2020-10/ibge-obesidade-mais-do-que-dobra-na-populacao-com-mais-de-20-anos8. Knight M, Bunch K, Tuffnell D, Patel R, Shakespeare J, Kotnis R,
et al. Saving Lives, Improving Mothers' Care. 2021. [
Internet]. [acesso em 2024 Mar 13]. Disponível em:
https://www.npeu.ox.ac.uk/assets/downloads/mbrrace-uk/reports/maternal-report-2021/MBRRACE-UK_Maternal_Report_2021_-_FINAL_-_WEB_VERSION.pdf9. Bolognani CV, Souza SS, Paranhos Calderon IM. Diabetes mellitus gestacional: enfoque nos novos critérios diagnósticos. Comun Ciênc Saúde. 2011; 22 (Supl. 1): S31-S42.
10. Rasmussen KM, Yaktine AL (editors); Institute of Medicine (US) and National Research Council (US) Committee to Reexamine IOM Pregnancy Weight Guidelines. Weight gain during pregnancy: reexamining the guidelines. Washington (DC): National Academies Press; 2009. 854 p.
11. Carrilho TRB, Farias DR, Batalha MA, Costa NCF, Rasmussen KM, Reichenheim ME,
et al. Brazilian Maternal and Child Nutrition Consortium: establishment, data harmonization and basic characteristics. Sci Rep. 2020 Set; 10 (1): 14869.
12. Kac G, Carilho TRB, Rasmussen KM, Reichenheim ME, Farias DR, Hutcheon JA. Gestational weight gain charts: results from the Brazilian Maternal and Child Nutrition Consortium. Am J Clin Nutr. 2021 Mar; 113 (5): 1351-60.
13. Kusinski LC, Murphy HR, De Lucia Rolfe E, Rennie KL, Oude Griep LM, Hughes D,
et al. Dietary Intervention in Pregnant Women with Gestational Diabetes; Protocol for the DiGest Randomised Controlled Trial. Nutrients. 2020 Abr; 12 (4): 1165.
14. Zajdenverg L, Façanha C, Dualib P, Golbert A, Negrato CA, Bertoluci M. Planejamento, metas e monitorização do diabetes durante a gestação. Diretriz da Sociedade Brasileira de Diabetes (2023). [
Internet]. [acesso em 2023 Dez 27]. Disponível em:
https://diretriz.diabetes.org.br/planejamento-metas-e-monitorizacao-do-tratamento-do-diabetes-durante-a-gestacao/15. American Diabetes Association (ADA). 15. Management of Diabetes in Pregnancy: Standards of Care in Diabetes - 2024. Diabetes Care. 2024 Jan; 47 (Suppl. 1): S282-94.
16. Lende M, Rijhsinghani A. Gestational Diabetes: Overview with Emphasis on Medical Management. Int J Environ Res Public Health. 2020 Dez; 17 (24): 9573.
17. Souza ÉSS, Saunders C, Carmo CN, Aquino Lacerda EM, Zajdenverg L, Castro MBT,
et al. Gestational weight gain and adverse maternal and perinatal outcomes among women with gestational diabetes mellitus according to International Association of Diabetes and Pregnancy Study Group (IADPSG) criteria: A cross sectional study. Clin Nutr ESPEN. 2022 Ago; 50: 207-11.
18. Godoy AC, Nascimento SL, Surita FG. A systematic review and meta-analysis of gestational weight gain recommendations and related outcomes in Brazil. Clinics (São Paulo). 2015 Nov; 70 (11): 758-64.
19. Balani J, Hyer S, Johnson A, Shehata H. The importance of visceral fat mass in obese pregnant women and relation with pregnancy outcomes. Obstet Med. 2014 Mar; 7 (1): 22-5.
20. Dalfra' MG, Burlina S, Lapolla A. Weight gain during pregnancy: A narrative review on the recent evidences. Diabetes Res Clin Pract. 2022 Jun; 188: 109913.
21. Lapolla A, Dalfrà MG, Fedele D. Management of gestational diabetes mellitus. Diabetes Metab Syndr Obes. 2009 Jun; 2: 73–82.
22. Dode MASO, Santos IS. Non classical risk factors for gestational diabetes mellitus: a systematic review of the literature. Cad Saúde Pública. 2009; 25: S341-59.
23. Ahmed B, Sultana R, Greene MW. Adipose tissue and insulin resistance in obese. Biomedicine & Pharmacotherapy. 2021 Mai; 137: 111315.
24. Eckel RH. Insulin resistance: an adaptation for weight maintenance. Lancet. 1992 Dez; 340 (8833): 1452–3.
25. Harreiter J, Simmons D, Desoye G, Corcoy R, Adelantado JM, Devlieger R,
et al. Nutritional Lifestyle Intervention in Obese Pregnant Women, Including Lower Carbohydrate Intake, Is Associated With Increased Maternal Free Fatty Acids, 3-β-Hydroxybutyrate, and Fasting Glucose Concentrations: A Secondary Factorial Analysis of the European Multicenter, Randomized Controlled DALI Lifestyle Intervention Trial. Diabetes Care. 2019 Jun; 42 (8): 1380–9.
26. Bogaerts A, Ameye L, Martens E, Devlieger R. Weight loss in obese pregnant women and risk for adverse perinatal outcomes. Obstet Gynecol. 2015 Mar; 125 (3): 566-75.
27. Pantham P, Aye ILMH, Powell TL. Inflammation in Maternal Obesity and Gestational Diabetes Mellitus. Placenta. 2015 Jul; 36 (7): 709-15.
28. Organização Pan-Americana da Saúde/Organização Mundial da Saúde (OPAS/OMS). Ministério da Saúde (BR). Federação Brasileira das Associações de Ginecologia e Obstetrícia. Sociedade Brasileira de Diabetes. Rastreamento e diagnóstico de diabetes mellitus gestacional no Brasil. Brasília (DF): OPAS; 2017 [
Internet]. [acesso em 2024 Abr 19]. Disponível em:
https://www.febrasgo.org.br/images/pec/CNE_pdfs/Rastreamento-Diabetes.pdf29. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD,
et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021 Mar; 372: 71.
Contribuição dos autoresVentorim PSC: Conceitualização, Coleta, Curadoria e Análise de dados, Pesquisa, Metodologia, design da apresentação dos dados, Redação do manuscrito original.
Souza FB: Software, Curadoria e Análise de dados, Pesquisa, Metodologia, design da apresentação dos dados.
Rodrigues LK: Software, Curadoria e Análise de dados.
Alves DJB: Software, Coleta e Curadoria de dados.
Petarli GB: Análise de Dados, Redação, revisão e edição do texto científico.
Cardoso LD: Redação, revisão e edição do texto científico.
Rocha JLM e Barbosa MCR: Orientação, Supervisão, Redação, revisão e edição do texto científico.
Todos os autores aprovaram a versão final do artigo e declaram não haver conflito de interesse.
Disponibilidade de DadosTodo o conjunto de dados que dá suporte aos resultados deste estudo foi publicado no próprio artigo.
Recebido em 27 de Maio de 2024
Versão final apresentada em 1 de Setembro de 2025
Aprovado em 10 de Setembro de 2025
Editor Associado: Karla Bomfim
 ; Fernando Barbosa de Souza3
; Fernando Barbosa de Souza3 ; Letícia Karina Rodrigues2
; Letícia Karina Rodrigues2 ; Débora Jandira Bruschi Alves3
; Débora Jandira Bruschi Alves3 ; Glenda Blaser Petarli2
; Glenda Blaser Petarli2 ; Luciane Daniele Cardoso3
; Luciane Daniele Cardoso3 ; José Luiz Marques-Rocha1
; José Luiz Marques-Rocha1 ; Míriam Carmo Rodrigues Barbosa1
; Míriam Carmo Rodrigues Barbosa1