RESUMO
OBJETIVOS: avaliar a incidência e fatores associados à displasia broncopulmonar (DBP) em egressos de Unidades de Terapia Intensiva Neonatal (UTIN).
MÉTODOS: estudo de coorte retrospectivo com prematuros egressos de UTIN. O processo amostral foi aleatório, considerando crianças em seguimento em ambulatório de alto risco com registro em UTIN no período de 2014 a 2018. A coleta foi realizada a partir de prontuários e entrevistas com as mães ou responsáveis, com informações referentes às intercorrências durante a gestação, condições de nascimento, cuidados e morbidades na UTIN. A DBP foi aferida para neonatos com utilização de oxigenioterapia por períodoigual ou superior a 28 dias ou 36 semanas de idade gestacional corrigida. Após análises bivariadas, seguiu-se análise de regressão logística binária. Para o modelo final definiu-se nível de significância de 5% (p<0,05), com registro das respectivas Odds Ratio e intervalos de confiança de 95%.
RESULTADOS: foram avaliados dados de 293 prematuros, predominantemente do sexo masculino (55,6%) e idade gestacional de 32 a 36 semanas. A DBP foi registrada para 63 crianças (21,5%). As variáveis que permaneceram estatisticamente associadas à DBP foram: peso de nascimento, idade gestacional e registro de sepse tardia.
CONCLUSÕES: registrou-se elevada incidência de DBP. Os fatores associados destacam a necessidade de melhoria dos cuidados pré e pós-natais
Palavras-chave:
Displasia broncopulmonar, Nascimento prematuro, Fatores de risco
ABSTRACT
OBJECTIVES: to evaluate the incidence and factors associated with bronchopulmonary dysplasia (BPD) in premature infantsdischarged from Neonatal Intensive Care Units (NICU).
METHODS: retrospective cohort study with premature infants discharged from the NICU. The sampling process was random, considering premature infants being followed up at a high-risk outpatient clinic registered in a NICU from 2014 to 2018. The collection was carried out from medical records and interviews with mothers or guardians, with information regarding complications during pregnancy, conditions of birth, care and morbidities in the NICU. BPD was measured for premature neonates using oxygen therapy for a period equal to or greater than 28 days or 36 weeks of corrected gestational age. After bivariate analyses, binary logistic regression analysis was followed. For the final model, a significance level of 5% (p<0.05) was defined, with registration of the respective Odds Ratio and 95% confidence intervals.
RESULTS: data from 293 preterm infants, predominantly male (55.6%) with gestational age from 32 to 36 weeks, were evaluated. BPD was recorded for 63 children (21.5%). The variables that remained statistically associated with BPD were: birth weight, gestational age and late sepsis.
CONCLUSIONS: there was a high incidence of BPD. Associated factors highlight the need for improving pre- and postnatal care.
Keywords:
Bronchopulmonary dysplasia, Premature birth, Risk factors
IntroduçãoNos últimos anos, os avanços nos cuidados intensivos perinatais e neonatais têm assegurado a sobrevida de recém-nascidos (RN) cada vez mais prematuros. Estima-se que, em todo o mundo, 13,4 milhões de recém-nascidos nasceram prematuramente (<37 semanas) em 2020, o que representa 10% de todos os nascimentos. Mais da metade desses nascimentos ocorreram em países em desenvolvimento.
1 As Unidades de Terapia Intensiva Neonatal (UTIN) têm registrado resultados positivos, mas as circunstâncias envolvidas na sobrevida do RN muito prematuro, implicam também em riscos de sequelas que podem comprometer a qualidade de vida das crianças e de suas famílias.
2Entre as principais morbidades que acometem o RN prematuro está a displasia broncopulmonar (DBP), uma condição clínica de etiologia complexa que envolve hiperplasia do epitélio brônquico do pulmão em desenvolvimento.
3,4 É descrita como uma condição com fatores de risco distintos e com registro de aumento da ocorrência especialmente em prematuros extremos
4. Em uma recente revisão sistemática publicada em 2021, os autores registraram que a incidência global relatada de DBP entre prematuros variou de 10-89%, com valores que alcançam percentuais de 73% na Europa, 89% na América do Norte, 82% na Ásia e 62% na Oceania.
5Nas duas últimas décadas, a DBP é reconhecida como uma doença que não é restrita somente ao período neonatal e que pode aumentar o risco para retinopatia da prematuridade e alterações neurológicas. Há outras morbidades também associadas à DBP que podem estar presentes até em crianças maiores, como diminuição da função pulmonar, aumento na incidência de enfisema e maior risco de sibilos. Adicionalmente, existem consequências extrapulmonares, como aumento do risco cardiovascular, maior incidência de hipertensão arterial na adolescência e na vida adulta.
6,7A literatura registra que os preditores ou fatores associados à BDP são diversos e multifatoriais, sendo que podem estar relacionadas ao período pré e pós-natal, incluindo: corioamnionite, restrição de crescimento intrauterino, baixa idade gestacional, baixo peso ao nascer, sexo masculino, menor Apgar, uso de esteroides pós-natais, hemorragia intraventricular grave, persistência do canal arterial, enterocolite necrosante, sepse tardia, necessidade de ventilação mecânica positiva, necessidade de oxigênio suplementar e aumento do aporte hídrico nos primeiros dias de vida.
3,4,6-8 A ocorrência da BDP ainda é significativa e tem aumentado, representando uma condição crítica para os cuidados familiares e dos serviços de saúde.
5Existem poucos estudos nacionais recentes sobre DBP. Uma das dificuldades para o desenvolvimento de estudos sobre o tema inclui o dilema que envolve a definição de DBP. Uma definição consensual apresentada em conjunto por três importantes órgãos nos Estados Unidos, o
National Institute of Child Health and Human Development, o
National Heart, Lung, and Blood Institute e o
NIH Office of Rare Diseases, no ano 2000 tem prevalecido e destaca um conceito funcional para a DBP considerando a necessidade de utilização de oxigenioterapia suplementar por neonatos prematuros por período igual ou superior a 28 dias ou 36 semanas de idade gestacional corrigida.
9,10É relevante conhecer todos os aspectos associados à DBP, possibilitando assim, intervenções oportunas. Nesse sentido, os estudos regionais podem ser úteis, orientando medidas rapidamente adaptáveis e intervenções mais efetivas. Não foram encontrados estudos sobre o tema para a região norte de Minas Gerais. Trata-se de uma região de grande extensão territorial (maior que vários estados brasileiros) cujos cuidados mais complexos de saúde estão centralizados em uma única cidade. A região é reconhecida uma das mais carentes do país, considerando seus indicadores socioeconômicos e registra ainda carência de recursos técnicos e humanos para a assistência à saúde materno-infantil. Em Montes Claros, cidade polo da região, encontra-se o único ambulatório de seguimento para as crianças nascidas prematuramente e egressas de UTIN. Nessa perspectiva, este estudo objetivou avaliar a incidência e fatores associados à displasia broncopulmonar em egressos de UTIN no norte de Minas Gerais.
MétodosTrata-se de um estudo de coorte retrospectivo desenvolvido no ambulatório de seguimento de recém-nascidos de alto risco que atende os recém-nascidos egressos das UTIN, em Montes Claros (MG). A cidade é o principal polo urbano da região norte de Minas e conta com uma população de aproximadamente 415 mil habitantes.
11 Em relação aos serviços de atenção primária, a cidade possui cobertura plena, com registro de mais de 150 equipes da Estratégia Saúde da Família, que são responsáveis pela captação e pelo acompanhamento à gestação de risco habitual. As gestações de alto-risco são acompanhadas em um centro especializado para atendimento à saúde da mulher. Existem três grandes maternidades na cidade com serviços de UTIN e a região norte conta com outras duas UTIN em cidades satélites. Os recém-nascidos são inseridos no ambulatório de seguimento, após alta das UTIN, a partir do encaminhamento detalhado das condições de nascimento e histórico da permanência hospitalar e são acompanhados por equipe multiprofissional.
A população do estudo foi constituída por recém-nascidos prematuros (idade gestacional registrada em prontuário inferior a 37 semanas). O processo amostral foi aleatório, considerando os neonatos admitidos nas UTIN no período de março de 2014 a julho de 2018, independente do peso ao nascer. Foram excluídas as crianças portadoras de malformações graves. Foram consideradas perdas as crianças cujos prontuários estavam com informações faltantes e as mães/responsáveis não sabiam informar. Para o cálculo amostral estimou-se um nível de confiança de 95%, um poder de 80%, uma relação não-expostos/expostos e Risco Relativo estimados igual a três, o que definiu um tamanho de amostra mínimo de 290 crianças. Esses valores foram considerados a partir de estudos similares, considerando a ausência de estudos locais prévios.
7,12-15 Considerando perdas potenciais, o número de prontuários estimados foi acrescido de 20%. Para o processo de amostragem aleatória, a partir da sequência de números de prontuários registrados a cada mês, foram realizados sorteios de seis a oito prontuários a cada mês do período considerado para estudo. O fluxograma apresentado na Figura 1 detalha a alocação de perdas do processo. A coleta dos dados foi conduzida por uma equipe especialmente treinada a partir do uso de formulário desenvolvido para este estudo. Os dados foram coletados a partir de análises dos prontuários das crianças cadastradas após alta da UTIN e por intermédio de entrevistas realizadas com as mães ou responsáveis.
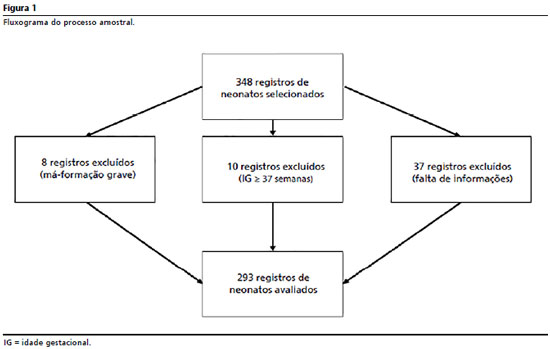
Foram coletadas informações referentes às intercorrências durante a gestação (hipertensão arterial materna, diabetes materna, registro materno de infecção do trato urinário durante a gestação e uso de corticoide anteparto), condições de nascimento (tipo de parto, sexo do neonato, peso ao nascimento, idade gestacional e necessidade de reanimação em sala de parto), cuidados e intercorrências/morbidades registradas durante a permanência na UTIN (sepses precoce e tardia, apneia, convulsões, enterocolite necrosante, parada cardíaca, hemorragia intracraniana, cardiopatia congênita, necessidade de hemotransfusão, como marcador de anemia grave e uso de aminas vasoativas, como marcador de instabilidade hemodinâmica grave e tempo de ventilação mecânica). A variável resposta foi o registro de displasia broncopulmonar (DBP). A definição de DBP foi aferida, seguindo os referenciais já apresentados.
9,10 Não foi possível a classificação da DBP pela falta de registro em alguns prontuários sobre a fração inspirada de oxigênio (FiO
2).
Para o processamento dos dados, utilizou-se o software
IBM-SPSS for Windows versão 22.0. Foi realizada a distribuição de frequência das principais variáveis e análise bivariada para identificação das variáveis associadas à DBP. Aquelas que se mostraram associadas até o nível de 20% (
p<0,20) foram avaliadas de forma conjunta por meio de regressão logística binária. Para o modelo final apenas as variáveis associadas até o nível de significância de 5% (
p<0,05) foram mantidas, com registro das respectivas
Odds Ratio e intervalos de confiança de 95%.
A pesquisa foi conduzida com respeito a todos os aspectos éticos e o projeto de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa da instituição sede do estudo (Universidade Estadual de Montes Claros-MG), conforme o parecer nº 1.800.915 e CAAE: 58699016.8.0000.5146.
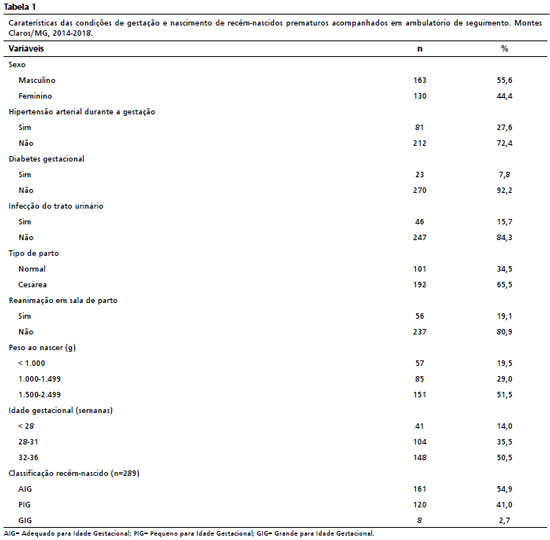
ResultadosParticiparam do estudo 293 prematuros egressos de UTIN e em acompanhamento no ambulatório de seguimento de recém-nascidos de alto risco. Destes, 163 (55,6%) eram do sexo masculino, 57 (19,5%) tiveram peso de nascimento inferior a mil gramas. O grupo avaliado foi formado, sobretudo por prematuros moderados, ou seja, com idade gestacional entre 32 e 36 semanas (50,5%). Essas e outras características do grupo avaliado estão apresentadas na Tabela 1.
A DBP foi registrada para 63 (21,5%) dos recém-nascidos. A Tabela 2 apresenta os resultados das análises bivariadas referentes às associações entre condições de gestação, nascimento e características de recém-nascidos prematuros e ocorrência de DBP. As variáveis com níveis descritivos ou probabilidade de significância mais notáveis foram o peso de nascimento e a idade gestacional. A Tabela 3 apresenta os resultados das análises bivariadas referentes às associações entre intercorrências e morbidades registradas para os neonatos durante a permanência na UTIN e presença de DBP. Nesta tabela, quase todas as intercorrências avaliadas apresentaram notáveis níveis descritivos ou probabilidade de significância (com
p<0,001).
Após análise múltipla as variáveis que permaneceram estatisticamente associadas com a DBP foram, a idade gestacional, o peso de nascimento e o registro de sepse tardia, conforme destacado na Tabela 4.
DiscussãoEste estudo revelou uma elevada incidência de DBP para o grupo avaliado, especialmente, considerando que abordou apenas crianças em acompanhamento em ambulatório para recém-nascidos de alto risco. Ou seja, trata-se de um valor registrado apenas entre sobreviventes. A literatura registra valores discrepantes de ocorrência de DBP, pois não existe uniformização de grupos avaliados. No Brasil e América Latina, os valores variam de 20,0% a 30,0%,
7,12-15 segundo o grupo de neonatos ou local avaliado.
Estudo realizado em Cuba incluindo apenas recém-nascidos de muito baixo peso identificou uma incidência de 20%.
15 Na Argentina, avaliando também neonatos com peso de nascimento inferior a 1500 gramas, a incidência observada foi de 22%.
7 Outros países registram valores mais baixos, como nas redes neonatais do Canadá e do Japão, com taxas que variaram de 12,3% a 14,6%, respectivamente, para recém-nascidos de muito baixo peso.
16 Mas também existem registros de incidência mais elevada, como de 28,7 % na Espanha
17 ou 26,2% a 30,4%, na
Vermont Oxford Network, nos Estados Unidos.
18 Todavia, é relevante destacar que alguns desses estudos, embora bem conduzidos, têm mais de dez anos de publicação.
Valores elevados de DBP, como observados neste estudo, destacam a necessidade de revisão das práticas assistenciais por parte das equipes de saúde tanto em relação aos cuidados antes como depois do nascimento. A literatura registra que os preditores da DBP são multifatoriais e podem ter associação com condições pré, peri ou pós-natais.
3,4,6-8,19 Neste estudo, as variáveis que se mostraram associadas à ocorrência de DBP foram o peso de nascimento, a idade gestacional e a ocorrência de sepse tardia.
Efetivamente, o nascimento prematuro e o baixo peso de nascimento configuram como os principais e mais fortes fatores associados à DBP, com registros de incidência e gravidade inversamente proporcionais tanto à idade gestacional como ao peso de nascimento.
4,7,14,19 Existe uma imaturidade estrutural e funcional em vários sistemas do neonato prematuro e/ou de baixo peso devido ao nascimento prematuro que determinam a necessidade de intervenções no sentido de preservar a vida. Entre essas medidas, destaca-se a necessidade de suplementação de oxigênio, muitas vezes com o apoio de ventilação mecânica. Esses fatores, isoladamente ou em conjunto, estão intrinsecamente associadas ao estresse oxidativo e à hiperoxia, que implicam em danos diretos ao pulmão prematuro, interrompendo o processo de desenvolvimento e maturação pulmonar.
19 Estudos em modelos animais demonstram que a exposição a altas concentrações de oxigênio por si só pode induzir inflamação, fibrose e enfisema em pulmões imaturos.
20 Sob o ponto de vista fisiopatológico, a hiperoxia resulta em lesão e morte das células endoteliais, seguida de dano celular epitelial e ruptura da membrana alvéolo-capilar com subsequente comprometimento da troca gasosa.
19É relevante observar que o peso de nascimento abaixo de mil gramas não se manteve como variável associada no modelo final, ainda que o intervalo de confiança tenha registrado uma tendência não desprezível. Para os autores, esse fato pode ser decorrente de o estudo ter abordado apenas os neonatos sobreviventes. Nesse sentido, neonatos de baixo peso extremo que tiveram DBP não foram inseridos no estudo porque não sobreviveram à condição ou a outras intercorrências. Embora exista uma correlação muito próxima entre peso de nascimento e idade gestacional, essas variáveis apontam para características distintas acerca dos mecanismos de desenvolvimento da DBP. Em um estudo realizado com gêmeos prematuros, observou-se que o crescimento intrauterino discordante foi um fator determinante nos desfechos de morbidade e mortalidade. Ente os pares levemente discordantes, observou-se maior risco de DBP ou morte. Para os pares muito discordantes, o menor apresentou maior incidência de sepse, uso e permanência em ventilação mecânica e também DBP, além de maior mortalidade.
21Embora vários fatores registrados na literatura como preditores pós-natais da BPD tenham sido identificados nas análises bivariadas deste estudo, apenas a sepse tardia se manteve no modelo final. Essa associação já foi apontada por outros autores.
15,17,22-25 Alguns autores argumentam que, entre os fatores pós-neonatais associados à DBP, existe um mecanismo comum que é caracterizado pela produção de citocinas inflamatórias, que podem ocorrer a partir da própria síndrome do desconforto respiratório, da ventilação mecânica invasiva, da oferta de oxigênio e da sepse, sendo que esta, propicia um processo inflamatório local e sistêmico ao mesmo tempo.
22,23 Em um estudo de coorte prospectivo realizado a partir de dados coletados 64 UTIN coreanas, observou-se que a incidência de DBP foi significativamente associada com a sepse tardia. O estudo observou ainda um aumento do risco para quadros repetidos de sepse tardia e maior gravidade em casos de sepse fúngica.
22Além dos mecanismos fisiopatológicos envolvidos diretamente com o processo infeccioso, a sepse tardia é, frequentemente, um quadro grave, quase sempre acompanhado por alterações hemodinâmicas e manifestações clínicas diversas, cujos germes envolvidos são, muitas vezes de origem nosocomial, incluindo fungos.
26 Em decorrência da gravidade associada à sepse tardia, a maioria dos neonatos acometidos necessita de iniciar ou manter suporte ventilatório mecânico e, nesse sentido, o oxigênio suplementar e a ventilação mecânica positiva, isoladamente, são fatores de risco para a BDP.
2,4,19Existem autores que registram outros fatores associados à DBP que não foram identificados neste estudo, como por exemplo, uso de surfactante,
14 necessidade de reanimação em sala de parto,
15 persistência do canal arterial,
7,13 ventilação mecânica.
7,13,14,17 Embora esses fatores tenham sido identificados nas análises iniciais (bivariadas), não se mantiveram no modelo final. Esse fato pode ser decorrente das particularidades dos grupos avaliados em cada estudo. Para além dos resultados observados neste estudo, é relevante que os profissionais se atentem à implementação de estratégias e práticas assistenciais que devem ser assumidas para a redução da ocorrência da DBP. Os impactos e os efeitos sinérgicos de intervenções perinatais baseadas em evidências sobre os desfechos primários de DBP têm sido recentemente descritos na literatura e incluem uso do corticosteroide antenatal, nascimento em centros com UTIN terciária, prevenção de intubação na sala de parto, terapia precoce com cafeína e extubação precoce.
27Sobre os esteroides antenatais, um estudo longitudinal que acompanhou mais de onze mil neonatos concluiu que para aqueles entre 22 a 28 semanas de idade gestacional, qual exposição a corticosteroides comparada a nenhuma exposição está associada a menores taxas de mortalidade, mas a taxa de DBP não se mostrou diferente.
28 Por outro lado, duas revisões sistemáticas do grupo
Cochraine, uma delas com 30 estudos e outra com 27 estudos, mostraram importante impacto na redução das taxas de DBP, quando se compara uso de corticosteroides com placebo ou nenhuma intervenção.
29,30 Ou seja, as evidências mais recentes e de alta qualidade sugerem que o uso de esteroides pré-natais é eficaz na redução do risco de DBP em recém-nascidos prematuros e apoiam o uso de esteroides pré-natais como uma intervenção importante para melhorar os resultados respiratórios em neonatos prematuros.
Os resultados observados devem ser considerados à luz de algumas limitações. Neste estudo, conforme já destacado, o grupo avaliado foi identificado a partir de neonatos sobreviventes e em acompanhamento em um ambulatório de seguimento. Assim, é possível que outras variáveis se mostrassem associadas a partir de uma coorte concorrente. Não foi possível a classificação da gravidade da DBP e, nesse sentido, não é possível estabelecer sinais de alerta mais acurados para os profissionais dos serviços envolvidos. Apesar dessas considerações, o estudo tem resultados importantes para a região, ao apontar a necessidade de intervenções nos cuidados materno-infantil, tanto pré-natais, para redução da prematuridade e do baixo peso, quanto pós-natais, para a redução dos quadros infecciosos. Concluindo, registra-se uma elevada incidência de displasia broncopulmonar para o grupo avaliado que se mostrou associada à prematuridade, baixo peso de nascimento e sepse tardia. Esses fatores alertam para a necessidade de políticas mais efetivas para melhoria da assistência pré-natal e dos cuidados nas Unidades de Terapia Intensiva Neonatal.
Referências1. Ohuma EO, Moller AB, Bradley E, Chakwera S, Hussain-Alkhateeb L, Lewin A,
et al. National, regional, and global estimates of preterm birth in 2020, with trends from 2010: a systematic analysis. Lancet. 2023; 402 (10409): 1261-71.
2. Bedi PK, DeHaan K, MacLean JE, Castro-Codesal ML. Predictors of longitudinal outcomes for children using long-term noninvasive ventilation. Pediatr Pulmonol. 2021; 56 (5): 1173-81.
3. Jensen EA, Dysart K, Gantz MG, McDonald S, Bamat NA, Keszler M,
et al. The Diagnosis of Bronchopulmonary Dysplasia in Very Preterm Infants. An Evidence-based Approach. Am J Respir Crit Care Med. 2019; 200 (6): 751-9.
4. Higgins RD, Jobe AH, Koso-Thomas M, Bancalari E, Viscardi RM, Hartert TV,
et al. Bronchopulmonary Dysplasia: Executive Summary of a Workshop. J Pediatr. 2018; 197: 300-8.
5. Siffel C, Kistler KD, Lewis JFM, Sarda SP. Global incidence of bronchopulmonary dysplasia among extremely preterm infants: a systematic literature review. J Matern Fetal Neonatal Med. 2021; 34 (11): 1721-31.
6. Yang Y, Li J, Mao J. Early diagnostic value of C-reactive protein as an inflammatory marker for moderate-to-severe bronchopulmonary dysplasia in premature infants with birth weight less than 1500 g. Int Immunopharmacol. 2022; 103: 108462.
7. Brener Dik PH, Niño Gualdron YM, Galletti MF, Cribioli CM, Mariani GL. Bronchopulmonary dysplasia: incidence and risk factors. Arch Argent Pediatr. 2017; 115 (5): 476-82.
8. Hwang JS, Rehan VK. Recent Advances in Bronchopulmonary Dysplasia: Pathophysiology, Prevention, and Treatment. Lung. 2018; 196 (2): 129-38.
9. Ibrahim J, Bhandari V. The definition of bronchopulmonary dysplasia: an evolving dilemma. Pediatr Res. 2018; 84: 586-8.
10. Jobe AH, Bancalari E. Bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2001; 163: 1723-9.
11. Instituto Brasileiro de Geografia e Estatística (IBGE). Cidades e Estados. 2024. [acesso em 2024 Jan 15]. Disponível em:
https://www.ibge.gov.br/cidades-e-estados/mg/montes-claros.html12. Tapia JL, Agost D, Alegria A, Standen J, Escobar M, Grandi C,
et al.; NEOCOSUR Collaborative Group. Bronchopulmonary dysplasia: incidence, risk factors and resource utilization in a population of South American very low birth weight infants. J Pediatr. 2006; 82: 15-20.
13. Freitas BAC, Peloso M, Silveira GL, Longo GZ. Prevalência e fatores associados à displasia broncopulmonar em hospital de referência para microrregião de Minas Gerais. Rev Bras Ter Intensiva. 2012; 24 (2): 179-83.
14. Carillo-Franco J, Guevara-Suta S, Mendoza-Romero D. Displasia broncopulmonar y surelación com los cuidados respiratorios en prematuros menores de 32 semanas en una unidad neonatal, Bogotá 2017. Medicas UIS. 2021; 34 (2): 41-7.
15. Zavaleta-Gutierrez FE, Concepción-Urteaga LA, Concepción-Zavaleta MJ, Aguilar-Villanueva DA. Factores de riesgo y displasia broncopulmonar em reciénnacidos prematuros de muy bajo peso al nacer. Rev Cuba Pediatr. 2019; 91 (1): e600.
16. Isayama T, Lee SK, Mori R, Kusuda S, Fujimura M, Ye XY,
et al.; Canadian Neonatal Network; Neonatal Research Network of Japan. Comparison of mortality and morbidity of very low birth weight infants between Canada and Japan. Pediatrics. 2012; 130 (4): e957-65.
17. Alonso AS, Díaz SP, Soto RS, Ávila-Álvarez A. Epidemiología y factores de riesgo asociados a displasia broncopulmonar en prematuros menores de 32 semanas de edad gestacional. An Pediatr. 2022; 96 (2): 242-51.
18. Horbar JD, Carpenter JH, Badger GJ, Kenny MJ, Soll RF, Morrow KA. Mortality and neonatal morbidity among infants 501 to 1500 grams from 2000 to 2009. Pediatrics. 2012; 129 (6): 1019-26.
19. Thekkeveedu RK, Guaman MC, Shivanna B. Bronchopulmonary dysplasia: A review of pathogenesis and pathophysiology. Respir Med. 2017; 132: 170-7.
20. Ambalavanan N, Morty RE. Searching for better animal models of BPD: A perspective. Am J Physiol Lung Cell Mol Physiol. 2016; 311 (5): L924-7.
21. Sabatelli D, Milet B, Mena P, Domínguez A. Growth restriction increases the risk of bronchopulmonary dysplasia, death, and sepsis in twins of 30 weeks or less of gestation. Rev Chil Pediatr. 2019; 90 (1): 36-43.
22. Jung E, Lee BS. Late-onset sepsis as a risk factor for bronchopulmonary dysplasia in extremely low birth weight infants: a nationwide cohort study. Sci Rep. 2019; 9: 15448.
23. Lahra MM, Beeby PJ, Jefery HE. Intrauterine infammation, neonatal sepsis, and chronic lung disease: a 13-year hospital cohort study. Pediatrics. 2009; 123: 1314-9.
24. Shah J, Jefferies AL, Yoon EW, Lee SK, Shah PS; Canadian Neonatal Network. Risk Factors and Outcomes of Late-Onset Bacterial Sepsis in Preterm Neonates Born at<32 Weeks’ Gestation. Am J Perinatol. 2015; 32 (7): 675-82.
25. Ebrahimi ME, Romijn M, Vliegenthart RJS, Visser DH, van Kaam AH, Onland W. The association between clinical and biochemical characteristics of late-onset sepsis and bronchopulmonary dysplasia in preterm infants. Eur J Pediatr. 2021; 180 (7): 2147-54.
26. Shane AL, Sánchez PJ, Stoll BJ. Neonatal sepsis. Lancet. 2017; 390 (10104): 1770-80.
27. Chen X, Yuan L, Jiang S, Gu X, Lei X, Hu L,
et al. Synergistic effects of achieving perinatal interventions on bronchopulmonary dysplasia in preterm infants. Eur J Pediatr. 2024; 183: 1711-21.
28. Travers CP, Carlo WA, McDonald SA, Das A, Bell EF, Ambalavanan N,
et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Mortality and pulmonary outcomes of extremely preterm infants exposed to antenatal corticosteroids. Am J Obstet Gynecol. 2018 Jan; 218 (1): 130.e1-130.e13.
29. Roberts D, Brown J, Medley N, Dalziel SR. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database Syst Rev. 2017 Mar; 3 (3): CD004454.
30. McGoldrick E, Stewart F, Parker R, Dalziel SR. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database Syst Rev. 2020 Dec; 12 (12): CD004454.
Contribuição dos autoresMenezes MSD: idealização e coordenação do projeto de pesquisa, coleta e análise de dados, escrita e revisão do manuscrito. Dias VF: coleta e análise de dados, escrita e revisão do manuscrito. Araújo DD, Carneiro JA e Pinho L: análise de dados, escrita e revisão do manuscrito. Caldeira AP: idealização e coordenação do projeto de pesquisa, análise de dados, escrita e revisão do manuscrito. Todos os autores aprovaram a versão final do artigo e declaram não haver conflito de interesses.
Recebido em 29 de Agosto de 2023
Versão final apresentada em 3 de Julho de 2024
Aprovado em 18 de Julho de 2024
Editor Associado: Karla Bomfim
 ; Victor Figueiredo Dias 2
; Victor Figueiredo Dias 2 ; Diego Dias de Araújo 3
; Diego Dias de Araújo 3 ; Jair Almeida Carneiro 4
; Jair Almeida Carneiro 4 ; Lucineia de Pinho 5
; Lucineia de Pinho 5 ; Antônio Prates Caldeira 6
; Antônio Prates Caldeira 6