RESUMO
OBJETIVOS: avaliou-se a qualidade microbiológica do leite humano (LH) cru de doadoras do Banco de Leite Humano (BLH) da Santa Casa de Misericórdia de Ouro Preto.
MÉTODOS: a qualidade microbiológica do leite de cada uma das 10 doadoras em triplicata (30 amostras) foi avaliada por meio da enumeração de Staphylococcus aureus e mesófilos aeróbios totais (plaqueamento em superfície) e coliformes totais e termotolerantes (Número Mais Provável - NMP). Para verificar a conformidade dos procedimentos de extração e armazenamento do leite pelas doadoras, aplicou-se um questionário e um checklist após o término da coleta das amostras.
RESULTADOS: observou-se inadequações nos procedimentos de expressão e armazenamento do LH doado. A presença de todos os microrganismos estudados foram verificados no leite de todas as doadoras e, em alguns casos, excedeu os limites de segurança. O checklist indicou que alguns procedimentos higiênico-sanitários necessários não foram realizados criteriosamente, tornando importante orientar adequadamente as doadoras.
CONCLUSÕES: este estudo aponta um cenário desfavorável para a segurança e a qualidade do LH doado, sendo importante incentivar mais estudos a serem realizados para que a rede brasileira de BLH adote critérios mais rigorosos de instruções sobre procedimentos e suporte para doadoras de LH.
Palavras-chave:
Doadora, Microbiologia de alimentos, Leite humano, Bancos de leite, Controle de qualidade
ABSTRACT
OBJECTIVES: microbiological quality of raw human milk (HM) from donors at the HMB (Human Milk Bank) of Santa Casa de Misericórdia de Ouro Preto was evaluated.
METHODS: the microbiological quality of milk from each of 10 donors in triplicate (30 samples) was evaluated by enumeration of Staphylococcus aureus and total aerobic mesophiles (surface plating) and total and thermotolerant coliforms (Most Probable Number - MPN). A questionnaire and a checklist were applied after the end of sample collection to verify the compliance of milk extraction and storage procedures by the donors.
RESULTS: inadequacies in the procedures for expression and storage of donated HM were observed. The presence of all microorganisms studied were verified in the milk of all donors, and in some cases exceeded the safety limits. The checklist indicated that some necessary hygienic-sanitary procedures were not carefully performed, making it important to properly guide the donors.
CONCLUSIONS: this study points to an unfavorable scenario for the safety and quality of donated HM, and it is important to encourage further studies to be conducted so that the Brazilian network of HMB adopts stricter criteria for instructions on procedures and support for HM donors.
Keywords:
Donor, Food microbiology, Human milk, Milk banks, Quality control
IntroduçãoO leite humano tem propriedades antimicrobianas que retardam a deterioração causada pela microbiota primária, porém, tem pouca eficácia contra contaminantes secundários do ambiente, utensílios de cozinha e das mães.
1 Por ser rico em nutrientes, é um excelente meio de cultura para o crescimento de vários microrganismos, portanto, o LH deve ser manipulado em condições higiênico-sanitárias para evitar sua contaminação microbiológica.
2Segundo Grazziotin
et al.,
3 o número de amostras de LH que são descartadas nos BLH ainda é bastante elevado, possivelmente devido a erros que ocorrem nas etapas de manipulação e processamento que resultam em contaminação microbiológica. As causas por trás do aumento da quantidade de microrganismos no LH podem estar relacionadas a condições inadequadas de higiene da doadora, do meio ambiente e dos utensílios; técnicas de expressão inadequadas; e manutenção do leite fora da cadeia de frio durante seu transporte.
No Brasil, como em outros países, a expressão do LH na casa da doadora é permitida e incentivada, sendo considerada como uma forma segura e eficaz de obter maiores volumes de leite.
4 De acordo com a Organização Mundial da Saúde,
5 a alimentação de bebês prematuros com leite materno é recomendada como primeira escolha e, se este não estiver disponível, o LH pasteurizado, doado de um BLH estabelecido, deve ser a próxima alternativa. Assim, é assegurado um maior registro de doadoras e, consequentemente, uma maior doação de LH que possa atender às necessidades das Unidades de Terapia Intensiva Neonatal, que além de cuidados especiais, fornece aos recém-nascidos prematuros e/ou doentes, oLH, garantindo importantes benefícios deste alimento.
6É importante enfatizar que a expressão do leite em casa deve ser realizada em um ambiente que não implique risco à qualidade microbiológica e nutricional do mesmo, e a mãe deve seguir as diretrizes transmitidas pela equipe do BLH de sua cidade, para limpar e desinfetar utensílios, para higiene pessoal, expressão e armazenamento do leite.
7,8 O LH expresso na casa da doadora é encaminhado ao BLH para seu processamento sob uma cadeia de transporte controlada a baixas temperaturas, de acordo com padrões técnicos estabelecidos.
4A exposição de recém-nascidos a bactérias patogênicas presentes no LH, tais como
Staphylococcus aureus, pode causar doenças diarreicas, sepse neonatal, meningite e enterocolite necrosante.
9 Além disso, o crescimento de outras bactérias no leite leva à acidificação e fermentação, o que pode reduzir os componentes nutricionais e imunológicos devido ao uso de nutrientes do leite, contaminando a microbiota.
3,10,11Assim, o objetivo deste estudo foi avaliar a qualidade microbiológica do LH cru de doadoras do Hospital Santa Casa de Misericórdia de Ouro Preto. Este estudo é altamente relevante porque revela o perfil de qualidade higiênico-sanitária das doadoras através de uma avaliação microbiológica de seu leite, verificando se eles seguem os procedimentos de expressão correta que foram devidamente orientados pelos profissionais do BLH. De acordo com os resultados obtidos, se necessário, o BLH poderá adotar protocolos mais eficientes de treinamento e conscientização das doadoras, melhorando a qualidade do leite recebido e, consequentemente, a segurança para as crianças que o receberão.
MétodosO estudo foi realizado com a participação de todas as doadoras registradas no BLH da Santa Casa de Misericórdia de Ouro Preto. As participantes (dez) foram recrutadas por contato telefônico, após serem aprovadas pelo Comitê de Ética em Pesquisa da Universidade Federal de Ouro Preto, sob o número CAAE 71251517.9.0000.5150.
As participantes que forneceram seu leite materno deram seu consentimento para que fosse utilizado, assinando um termo de consentimento livre e esclarecido (TCLE) e caracterizaram-se por meio de um questionário estruturado aplicado e uma lista de verificação de procedimentos para expressão do leite, elaborada por profissionais do BLH da Santa Casa de Misericórdia de Ouro Preto, a fim de verificar a adequação das mães lactantes em relação aos procedimentos de expressão e armazenamento de LH recomendados pelo Ministério da Saúde.
4 É importante ressaltar que, para não interferir nos procedimentos comumente realizados pelas doadoras no momento da expressão, o questionário e a lista de verificação foram aplicados imediatamente após a última expressão do leite.
Imediatamente após a chegada do leite ao laboratório, foram analisados individualmente para
Staphylococcus aureus, coliformes totais e termotolerantes, e mesófilos aeróbios totais.
4 Os resultados foram apresentados individualmente em três réplicas.
Um total de 10 mL de LH de cada uma das 10 doadoras foram utilizados para realizar as análises. Foramfornecidos às doadoras em suas casas, uma garrafa de vidro transparente de boca larga previamente esterilizada com uma tampa plástica rosqueável. No dia da expressão, as garrafas contendo o LH foram transportadas para o laboratório de microbiologia da Escola de Nutrição da Universidade Federal de Ouro Preto, em uma caixa fria contendo gelo para manter uma temperatura máxima de 5°C, não excedendo 6 horas, conforme instruído pelo BLH.
4Os microorganismos
Staphylococcus aureus, coliformes totais e termotolerantes e mesófilos aeróbios totais foram determinados de acordo com métodos estabelecidos pela Instrução Normativa 62, publicada em 2003 pelo Ministério da Agricultura, Pecuária e Abastecimento.
12 Os Coliformes Total e Termotolerantes foram determinados pelo método do Número Mais Provável (NMP).
12ResultadosAs características das doadoras e de seus bebês estão descritas na Tabela 1. Todas moravam no município de Ouro Preto - MG e estavam em fase de produção de leite maduro. A idade das doadoras variava de 21 a 32 anos, com uma média de 26,6 anos. Em relação à educação, 50% tinham o ensino médio completo e 20% tinham o ensino superior completo. Com relação ao emprego, 70% das doadoras estavam empregadas e a faixa de renda mais comum estava entre 1 e 3 salários mínimos (40%). Com relação ao peso ao nascer, 60% das crianças nasceram com peso adequado, ou seja, entre 3.000 a 3.9999 g e não houve nascimentos prematuros.
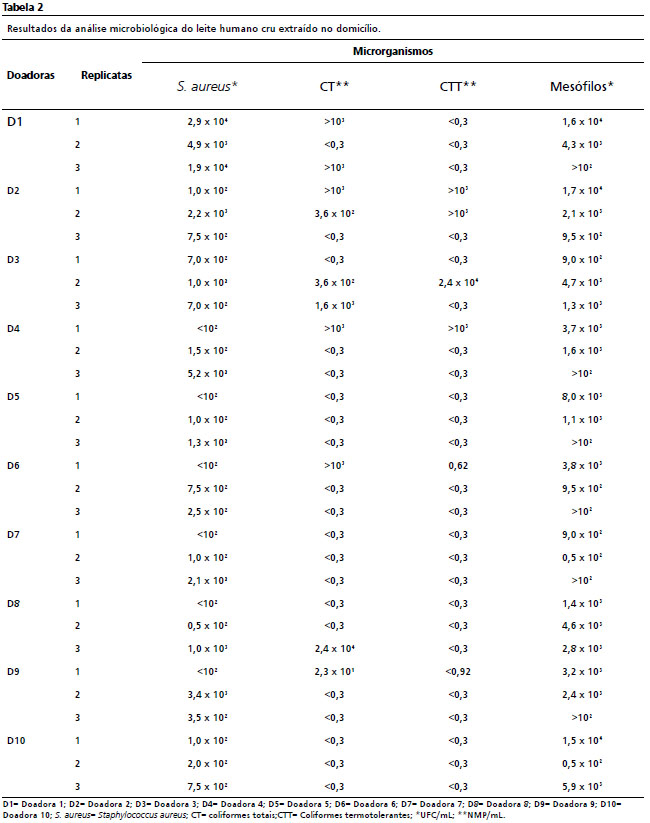
13 Com relação à qualidade microbiológica do leite doado, como mostrado na Tabela 2, as contagens de
Staphylococcus aureus variaram de < 102 e 2,9×104 UFC/mL. A contaminação do leite por coliformes totais e termotolerantes variou de < 0,3 a > 103 NMP/mL. A contagem de aeróbulos mesófilos totais variou de 0,5×10² a 1,7×104 UFC/mL.
A Tabela 3 apresenta a prevalência da adequação dos itens que compõem a lista de verificação aplicada as doadoaes. Em relação aos cuidados com o frasco de coleta, o item com maior frequência de inadequação foi “escolher um local tranquilo, limpo, sem animais ao redor, ao extrair o leite” com 40% de adequação. Os itens referentes aos cuidados de higiene e técnicas de ordenha que apresentaram menor frequência de adequação (10%) foram “evitar a influência do vento durante a expressão” e “amarrar o cabelo, usar máscara ou similar - cobrir nariz e boca”, enquanto 100% das doadoras concordaram em “lavar as mãos com bastante sabão e água corrente - secar com uma toalha limpa”. De acordo com relatos sobre os cuidados na pré-estocagem, embora 80% delas afirmarem fechar a garrafa e congelar imediatamente após a expressão, 30% afirmaram não encher a garrafa até a parte superior e manter as garrafas sempre no freezer por um máximo de 15 dias.
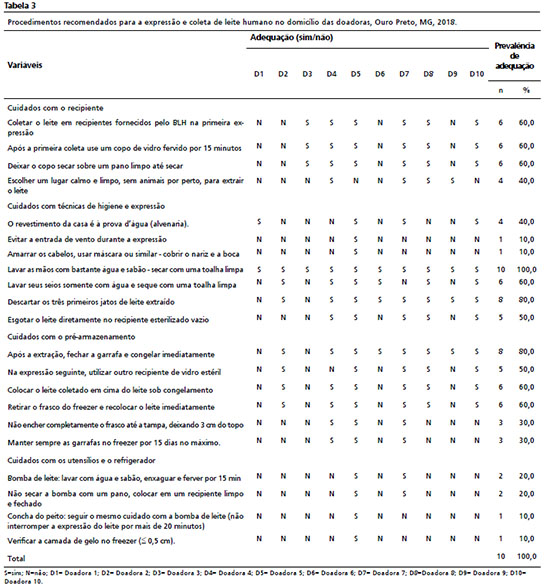
Os cuidados com utensílios e geladeira apresentaram a menor prevalência de adequação de todas as variáveis estudadas, variando de 10% a 20%. Apenas umados doadoras declarou “usar uma bomba de leite: seguir os mesmos cuidados da bomba de leite (não parar a expressão do leite por mais de 20 minutos)” e “verificar a camada de gelo do freezer (<0,5 cm)” e duas delas relataram que em relação a “bomba de leite, adotar os procedimentos de lavagem com água e sabão, enxágue e ferva por 15 minutos” e “não usar um pano para secá-lo, colocando-o em um recipiente limpo e fechado”.
DiscussãoOs parâmetros de qualidade do LH doado estabelecidos pelo Ministério da Saúde no Brasil referem-se ao leite após seu processo de pasteurização e na ausência de uma regulamentação nacional para o leite cru, torna-se interessante uma comparação com parâmetros internacionais. De acordo com o Ministério do Trabalho e Bem-Estar Social austríaco,
14 a contagem de
Staphylococcus aureus no LH deve ser <104 UFA/mL e uma contaminação acima deste valor foi encontrada em grande parte das amostras do presente estudo. As doadoras de leite D1, D4 e D9 apresentaram o nível mais alto de contaminação por
Staphylococcus aureus (Tabela 2), e ao analisar suas respostas na lista de verificação (Tabela 3), nenhuma das três amarrou o cabelo, usou uma máscara ou similar - cobrindo o nariz e a boca para a expressão do leite. A falta destes procedimentos pode estar associada ao crescimento e desenvolvimento do microrganismo no LH. Sua presença no leite pode ser devida à contaminação por uma fonte secundária, como passagens nasais, garganta, pele e cabelo, comum em partes do corpo humano ou mesmo devido a condições higiênico-sanitárias insatisfatórias dos utensílios utilizados em sua manipulação.
4,8A maior preocupação com a presença destes microrganismos em altas concentrações no leite materno é a ocorrência de cepas produtoras de toxinas, chamadas enterotoxinas, que são resistentes à pasteurização.
15 Neste caso, o tratamento térmico remove o microrganismo, mas não a toxina excretada no leite antes da pasteurização. As enterotoxinas são estáveis termicamente e resistentes à inativação por proteases gastrointestinais como pepsina e tripsina,
16 sendo então muito importante em termos de intoxicação alimentar,
17 pois mantêm sua atividade biológica mesmo após a pasteurização.
A apresentação clínica da intoxicação alimentar estafilocócica inclui essencialmente vômitos e diarreia, e os sintomas clínicos se manifestam após um curto período de incubação (em média 4 horas). Em recém-nascidos, devido à imaturidade imunológica, especialmente daqueles hospitalizados em uma Unidade de Terapia Intensiva, as enterotoxinas são responsáveis pelo aumento do tempo de hospitalização, da morbidade e da mortalidade.
18Atualmente, não há acordo universal sobre o limite superior seguro de carga bacteriana ou espécies no leite LH, o que requer o estabelecimento de diretrizes microbiológicas individuais utilizadas pelos BLH para aceitar e rejeitar o LH. Por exemplo, muitos BLH rejeitam qualquer lote de LH que contenha
Staphylococcus aureus ou qualquer outra bactéria produtora de toxinas pré-pasteurização.
19 Alguns BLH, entretanto, aceitam leite para pasteurização que contenha diferentes contagens viáveis de
Staphylococcus aureus, tais como <103 unidades formadoras de colônia (UFC)/mL,
20<104 UFC/mL
21 ou <105 UFC/mL
22,23 enquanto outros não realizam a triagem bacteriana no leite doado.
23A contaminação do leite por coliformes totais e termotolerantes variou de < 0,3 a > 103 NMP/mL (Tabela 2). O leite das doadoras D2 e D3 apresentou maior contaminação por coliformes totais e termotolerantes. Deve-se notar que estas duas doadoras relataram não amarrar seus cabelos, usando uma máscara ou similar - cobrindo o nariz e a boca. Além disso, elas não escolheram um local calmo e limpo para expressar o leite (Tabela 3). Assim, estas amostras de leite representam um risco à saúde do recém-nascido quando o leite não é tratado termicamente (oferecido diretamente entre mãe e filho), e por isso é importante reforçar as diretrizes sobre os procedimentos higiênico-sanitários adequados para o manuseio do leite, para seu próprio filho ou para doação ao BLH, que podem ser rejeitados após o controle de qualidade.
Os coliformes totais têm a capacidade de fermentar lactose a 37°C, com produção de gás, e são representados por mais de 20 espécies, algumas encontradas no trato gastrointestinal de humanos e animais.
24 Os coliformes termotolerantes, por sua vez, são caracterizados pela capacidade de fermentar lactose e produzir ácido e gás a uma temperatura de 45°C. Os coliformes são indicadores importantes da qualidade microbiológica do leite doado aos BLH.
25O LH é naturalmente mais ácido devido à presença de caseína, sais minerais e proteínas do soro de leite. Entretanto, a elevação desta acidez pode ocorrer devido à produção de ácido láctico resultante da fermentação da lactose pelo crescimento bacteriano quando encontram condições favoráveis para o crescimento, geralmente quando o leite é armazenado incorretamente, a temperaturas acima do recomendado.
26,27 De acordo com o Manual utilizado pela Rede Brasileira de Bancos de Leite Humano: “Banco de Leite Humano: Funcionamento, Prevenção e Controle de Riscos”
4, a presença de coliformes em uma amostra de LH cru destinado a BLH não exige que seja descartado, uma vez que este grupo de microrganismos é eliminado pelo processo de pasteurização. Neste caso, o fato de encontrar contaminação desse microrganismo no leite analisado neste estudo, não implica necessariamente na inadequação do leite fornecido pelos BLH, pois eles ainda não são pasteurizados, e serão submetidos a este processo nos BLH, inativando estas bactérias. Entretanto, se a contagem inicial for muito alta, haverá uma redução na carga microbiana, mas muitos microrganismos ainda permanecerão. O que deve ser enfatizado é que altas contagens indicam falhas no processo de expressão/higienização adotado pelas doadoras.
O controle de qualidade microbiológica do LH pasteurizado praticado pelos BLHs, que classifica o leite como adequado ou impróprio para consumo, é realizado pelo teste coliforme, sendo economicamente viável e seguro, minimizando a possibilidade de resultados falso-negativos.
28Em relação aos mesófilos aeróbios totais, a maioria das doadoras (D1, D4, D5, D6, D7 e D9) apresentou resultados elevados em pelo menos uma das réplicas. De acordo com a Rede Brasileira de BLH,
29 quando a expressão é realizada em condições higiênico-sanitárias corretas, o LH cru tem uma contagem total de microrganismos na ordem de 102 UFC/mL. Serra
et al.
30 encontraram contagens mesófilas aeróbias ≥105 UFC/mL em suas amostras de LH, acima da maioria dos valores relatados neste estudo, demonstrando condições higiênico-sanitárias ainda mais insatisfatórias.
A Rede Brasileira de BLH
29 enfatiza que a higienização inadequada de garrafas e bombas para a expressão do leite contribui para um aumento de até 3,5×107 UFC/mL na contagem total de bactérias e contaminação com microrganismos como os coliformes. Eles recomendam que, além dos cuidados de higiene pessoal de rotina, a mãe lactante seja instruída a aplicar seu próprio leite sobre a região do mamilo-areolar após a expressão, uma vez que o leite é rico em ésteres e ácidos graxos de cadeia curta que têm uma função bactericida.
29 Os resultados do presente estudo indicam que a maioria das amostras analisadas excederam os limites de segurança, demonstrando condições higiênico-sanitárias insatisfatórias da expressão, condicionamento e armazenamento pelas doadoras, exigindo o reforço das boas práticas de expressão e manipulação.
Os resultados obtidos são importantes não apenas para o BLH da cidade de Ouro Preto, mas para a Rede de BLH do Brasil, como em todo o mundo, pois aponta um cenário desfavorável para a segurança e qualidade do LH doado, sendo importante incentivar mais estudos a serem realizados para que as redes de BLH adotem critérios mais rigorosos e que possam estabelecer um protocolo de treinamento e avaliação de procedimentos que seja seguido pelas doadoras para garantir a qualidade do leite doado.
A presença de todos os organismos estudados foi encontrada nas amostras de leite de todas as doadoras e, em alguns casos, excedeu os limites de segurança. Os resultados da lista de verificação mostram que alguns procedimentos higiênico-sanitários exigidos não estão sendo realizados de forma criteriosa, o que pode estar relacionado ao desenvolvimento dos microrganismos encontrados nas amostras avaliadas. Portanto, é muito importante que os profissionais do BLH, responsáveis pela orientação da doadora, sejam informados sobre estes fatos para reforçar a orientação as doadoras quanto aos aspectos sanitários e higiênicos corretos.
Note que a contaminação encontrada no LH cru gera uma preocupação social, pois a maioria das doadoras trabalha fora de casa (70%) e também expressa leite para alimentar seus bebês enquanto eles estão ausentes. O leite expresso por uma mãe para seu bebê não precisa ser pasteurizado, mas pode expor os bebês a contaminações que geram riscos à saúde.
Referências1. Almeida JAG, Novak FR. Amamentação: um híbrido natureza-cultura. J. Pediatr (Rio J.). 2004; 80 (Supl. 5): S119-25.
2. Novak FR, Junqueira AR, Dias MSPC, Almeida JA. Sensorial analysis of expressed human milk and its microbial load. J Pediatr (Rio J.). 2008; 84 (2): 181-4.
3. Grazziotin AL, Grazziotin MCB, Letti LAJ. Disposal of human milk donated to a human milk bank before and after measures to reduce the amount of milk unsuitable for consumption. J Pediatr (Rio J.). 2010; 86 (4): 290-4.
4. Agência Nacional de Vigilância Sanitária (ANVISA). Banco de Leite Humano: Funcionamento, Prevenção e Controle de Riscos. Brasília (DF): ANVISA; 2008. [acesso em 2020 Mai 18] Disponível em:
https://www.anvisa.gov.br/servicosaude/manuais/manual_banco_leite.pdf5. World Health Organization(WHO). Global Strategy for Infant and Young Child Feeding. Geneva: WHO; 2003. [acesso em 2020 Mai 18] Disponível em:
https://www.who.int/publications/i/item/92415622186. Bicalho-Mancini PG, Velásquez-Meléndez G. Exclusive breastfeeding at the point of discharge of high-risk newborns at a Neonatal Intensive Care Unit and the factors associated with this practice. J Pediatr (Rio J.). 2004; 80 (3): 241-8.
7. Agência Nacional de Vigilância Sanitária (ANVISA). Resolução RDC nº 171, de 4 de Setembro de 2006. Dispõe sobre o Regulamento Técnico para o funcionamento de bancos de leite humano. Brasília (DF): DOU de 5 de Setembro de 2006. [acesso em 2020 Mai 18] Disponível em:
https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2006/res0171_04_09_2006.html8. Silva N, Junqueira VCA, Silveira NFA, Taniwaki MH, Gomes RAR, Okazaki MM. Manual de Métodos de Análise Microbiológica de Alimentos e Água. 5
a ed. São Paulo: Livraria Varela; 2010.
9. Haiden N, Ziegler EE. HumanMilk Banking. Ann NutrMetab. 2016; 69 (Supl. 2): 8-15.
10. Borges MS, Oliveira AMM, Hattori WT,Abdallah VOS.Quality of human milk expressed in a human milk bank and at home. J. Pediatr (Rio J.). 2018; 94 (4): 399-403.
11. Novak FR, Cordeiro DMB. The correlation between aerobic mesophilic microorganism counts and Dornic acidity in expressed human breastmilk. J Pediatr(Rio J.). 2007; 83 (1): 87-91.
12. Ministério da Agricultura, Pecuária e Abastecimento (BR). Instrução Normativa nº 62, de 26 de agosto de 2003. Oficializa os métodos analíticos oficiais para análises microbiológicas para controle de produtos de origem animal e água. Brasília (DF): DOU de 18 de Setembro de 2003. [acesso em 2020 Mai 18] Disponível em:
https://www.normasbrasil.com.br/norma/instrucao-normativa-62-2003_75166.html13. World Health Organization(WHO). An evaluation of infant growth: the use and interpretation of antropometry in infants. Bull World Health Organ. 1995; 73 (2): 165-74.
14. Austria Federal Ministry of Labour, Social Affairs, Health and Consumer Protection. Leitlinie für Errichtung und Betrieb einer Humanmilchbank. Wien, 2017. [acesso em 2020 Mai 18] Disponível em: HMB_Leitlinie_BMSGPK_CD_2020.pdf
15. Almeida JAG, Novak FR, Almeida CHG, Serva VB. Avaliação da flora microbiana do leite humano ordenhado no IMIP. Rev IMIP. 1998; 03: 13-6.
16. Rall VLM, Vieira FP, Rall R, Vieitis RL, Fernandes Jr A, Candeias JMG,
et al. PCR detection of staphylococcal enterotoxin genes in
Staphylococcus aureus strains isolated from raw and pasteurized milk. Vet Microbiol. 2008 Dec; 132 (3-4): 408-13.
17. Toubar SME, Elbialy AA, Zaky MMM, El-Shafey AA. Prevalence of Staphylococcus aureus in Raw Milk and Some Dairy Products in Port Said Governorate. Amer J Zoo. 2018; 1 (2): 40-6.
18. Pereira VC, Cunha MLRS. Coagulase-negative staphylococci strains resistant to oxacillin isolated from neonatal blood cultures. Mem Inst Oswaldo Cruz. 2013; 108 (7): 939-42.
19. Almutawif Y, Hartmann B, Lloyd M, Lai CT, Rea A, Geddes D.
Staphylococcus aureus Enterotoxin Production in Raw and Pasteurized Milk: The Effect of Selected Different Storage Durations and Temperatures. Breastfeed Med. 2019; 14 (4): 256-61.
20. Balmer, JH. Guidelines for the establishment and operation of human milk banks in the UK. Arch Dis Child EducPract Ed. 2004; 89: ep27–8.
21. Dewitte C, Courdent P, Charlet C, Dumoulin D, Courcol R, Pierrat Vet. Contamination of human milk with aerobic flora: Evaluation of losses for a human milk bank. Arch Pediatr. 2015; 22 (5): 461–7.
22. Arslanoglu S, Bertino E, Tonetto P, De Nisi G, Ambruzzi AM, Biasini A,
et al. Guidelines for the establishment and operation of a donor human milk bank. Italian Association of Human Milk Banks. J Matern Fetal Neonatal Med. 2010; 23 (2): 1-20.
23. Omarsdottir S, Casper C, Akerman A, Polberger S, Vanpée M. Breast milk handling routines for preterm infants in Sweden: A national cross sectional study. Breastfeed Med. 2008; 3 (3): 165-70.
24. Madigan MT, Martinko JM. Microbiologia de Brock. Porto Alegre (RS): Artmed; 2010
.25. Serafini AB, André MCDPB, Rodrigues MAV, Kipnis A, Carvalho CO, Campos MRH,
et al. Microbiological quality of human milk from a Brazilian milk bank. Rev SaúdePública. 2003; 37 (6): 775-9.
26. Moossavi S, Sepehri S, Robertson B, Bode L, Goruk S, Field CJ,
et al. Composition and variation of the human milk microbiota are influenced by maternal and early-life factors. Cell Host Microbe. 2019; 25 (2): 324-35.
27. Salerno T, Siqueira AK, Pinto JPAN, Da Cunha MLRS, Silvestre PK, Condas LAZ,
et al. Safety issues of raw milk: evaluation of bacteriological and physicochemical characteristics of human milk from a bank in a teaching hospital, focusing on Staphylococcus species. RevInst Med Trop São Paulo. 2021; 63:e54
28. Novak FR, Almeida JAG, Asensi MD. Resistência antimicrobiana de coliformes isolados de leite humano ordenhado. Cad Saúde Pública. 2001; 17 (3): 713-7.
29. Rede Brasileira de Bancos de Leite Humano (RBBLH). Determinação de acidez titulável - método Dornic. Rio de Janeiro: FIOCRUZ/IFF-BLH; 2005. [acesso em 2020 Mai 18] Disponível em:
https://rblh.fiocruz.br/sites/rblh.fiocruz.br/files/usuario/79/nt_29.11_determinacao_acidez_lho.pdf30. Serra VV, Teves S, López De Volder A, Ossorio F, Aguilar N, Armadans M. Comparison of the risk of microbiological contamination between samples of breast milk obtained at home and at a healthcare facility. ArchArgentPediatr. 2013; 111(2): 115-9.
Recebido em 20 de Julho de 2020
Versão final apresentada em 31 de Maio de 2022
Aprovado em 7 de Julho de 2022
Contribuição dos autores: Chaves JO e Menezes CC: Conceptualização (Equal); Curadoria de dados (Equal); Análise formal (Equal); Aquisição de fundos (Equal); Investigação (Equal); Metodologia (Equal); Administração de projectos (Equal); Recursos (Equal); Software (Equal); Supervisão (Equal); Validação (Equal); Visualização (Equal); Escrita - esboço original (Equal); Escrita - revisão & edição (Equal).
Fernandes AMF e Parreiras PM: Investigação (Apoio); Metodologia (Apoio).
Passos MC: Administração do projecto (Equal) Supervisão (Equal); Escrita - rascunho original (Equal); Escrita - revisão & edição (Equal).
Cunha LR: Conceptualização (Equal); Cura de dados (Equal); Análise formal (Equal); Investigação (Equal); Metodologia (Equal); Administração do projecto (Equal); Supervisão (Equal); Validação (Equal); Visualização (Equal); Escrita - rascunho original (Equal); Escrita - revisão & edição (Equal).
Todos os autores aprovaram a versão final do artigo e declaram não haver conflito de interesse.
 ; Angélica Maria de Freitas Fernandes2
; Angélica Maria de Freitas Fernandes2 ; Paola Machado Parreiras3
; Paola Machado Parreiras3 ; Maria Cristina Passos4
; Maria Cristina Passos4 ; Luciana Rodrigues da Cunha5
; Luciana Rodrigues da Cunha5 ; Camila Carvalho Menezes6
; Camila Carvalho Menezes6
